Roztroušená skleróza, její moderní léčba a problematika očkování
E. Pernicová
Centrum Očkování a cestovní medicíny Avenier, Brno-Bohunice
Souhrn
Roztroušená skleróza (RS, sclerosis multiplex) je multifaktoriální neurologické onemocnění, jehož příčinou je porucha imunitního systému s autoimunitními rysy. Pro klinický průběh je typické střídání období remisí a atak, které jsou spouštěny zátěží organizmu, často infekčním onemocněním nebo obecně stresovým podnětem různé etiologie. Terapeutické možnosti RS za poslední roky velmi pokročily. Kromě dlouho známých imunosupresiv se nově používá i tzv. imunomodulační léčba. Jejím cílem je snížení zánětlivé aktivity imunitních buněk. To vede ke stabilizaci klinických projevů, ale současně může negativně ovlivňovat imunitní reakci vůči infekčnímu patogenu nebo očkovací látce. V následujícím textu jsou uvedeny souhrnné informace z literárních zdrojů zabývajících se vztahem očkování a RS, resp. účinností vakcinace u pacientů léčených pro RS.
Klíčová slova
roztroušená skleróza – očkování – imunosuprese – imunomodulační léčba
Roztroušená skleróza, epidemiologie, klinické příznaky
Obecnou podstatou autoimunitních nemocí je chybná identifi kace vlastních antigenů, které jsou mylně interpretovány jako cizorodé a rozvíjí se vůči nim patologické zánětlivé reakce.
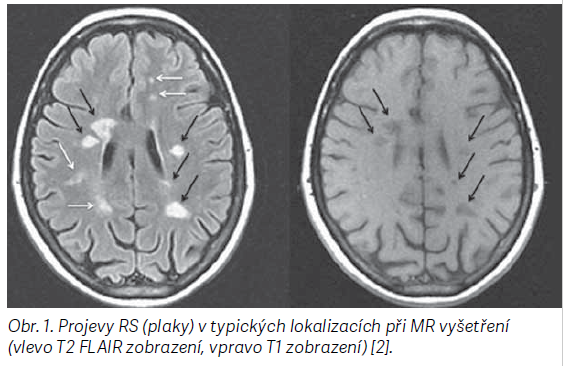
V případě RS zánět postihuje oligodendrocyty, tedy buňky, které zodpovídají za tvorbu myelinové pochvy neuronů a napomáhají přenosu elektrických signálů. Projevy onemocnění jsou tedy důsledkem demyelinizace, která je zpočátku provázena opravným procesem (remyelinizací). Postupně však toto hojení ustává a poškozený axon zůstane obklopený jizvovými plaky. Postižené oblasti, tzv. léze, bývají nejčastěji v oblasti bílé hmoty v blízkosti komor mozečku, mozkového kmene, bazálních ganglií, míchy a zrakového nervu [1]. Obr. 1 ukazuje typické léze při zobrazení magnetickou rezonancí (MR).
První příznaky se objevují nejčastěji mezi 20. a 40. rokem věku. Onemocnění se vyskytuje 2–3krát častěji u žen než u mužů. Prevalence nemoci v ČR se odhaduje na více než 170/ 100 000 obyvatel, incidence je přibližně 7–10 případů na 100 000 obyvatel za rok [3,4]. RS je nejčastější příčinou netraumatické invalidity mladých dospělých [3].
 Etiopatogeneze onemocnění je dosud nejasná. V lézích centrální nervové soustavy (CNS) jsou popsány zánětlivé a degenerativní pochody. V imunitních procesech se uplatňují vlivy genetické, hormonální a environmentální. Mezi rizikové faktory se řadí kouření, prodělané virové infekce, jako např. infekční mononukleóza, nedostatek vitaminu D, nadbytek soli v potravě či obezita. Nejčastější příčinou manifestace nebo zhoršení RS jsou stavy oslabení organizmu, tj. respirační či jiné infekce, stres, operační zátěž v souvislosti s celkovou anestezií, velmi diskutován je vliv očkování. U žen hraje roli také hormonální nestabilita – porod a poporodní období, menstruace, menarche a menopauza [3].
Etiopatogeneze onemocnění je dosud nejasná. V lézích centrální nervové soustavy (CNS) jsou popsány zánětlivé a degenerativní pochody. V imunitních procesech se uplatňují vlivy genetické, hormonální a environmentální. Mezi rizikové faktory se řadí kouření, prodělané virové infekce, jako např. infekční mononukleóza, nedostatek vitaminu D, nadbytek soli v potravě či obezita. Nejčastější příčinou manifestace nebo zhoršení RS jsou stavy oslabení organizmu, tj. respirační či jiné infekce, stres, operační zátěž v souvislosti s celkovou anestezií, velmi diskutován je vliv očkování. U žen hraje roli také hormonální nestabilita – porod a poporodní období, menstruace, menarche a menopauza [3].
Na narušení principu tolerance vlastního imunitního systému (IS) se podílejí zejména T lymfocyty. Při RS dochází k jejich prostupu přes hematoencefalickou bariéru (HEB) a k rozvoji zánětlivé reakce [1]. Také autoreaktivní B lymfocyty mohou pronikat přes HEB, kde poté dochází k syntéze imunoglobulinů. Nález oligoklonálních protilátek je považován za důkaz tzv. intratekální syntézy a využívá se v diagnostice této nemoci. B lymfocyty také fungují jako antigen-prezentující buňky a tvoří prozánětlivé (IL-10) i protizánětlivé (TNFa, IL-3) cytokiny [1,3].
 Klinickými projevy RS jsou poruchy zraku (retrobulbární neuritida, porušení okulomotoriky), hybnosti (centrální parézy), citlivosti, koordinace a ovládání sfinkterů, intenční tremor a jiné mozečkové příznaky vč. poruchy rovnováhy a sexuální dysfunkce. V pozdějších stadiích mohou být poruchy polykání a artikulace [3,5].
Klinickými projevy RS jsou poruchy zraku (retrobulbární neuritida, porušení okulomotoriky), hybnosti (centrální parézy), citlivosti, koordinace a ovládání sfinkterů, intenční tremor a jiné mozečkové příznaky vč. poruchy rovnováhy a sexuální dysfunkce. V pozdějších stadiích mohou být poruchy polykání a artikulace [3,5].
Léčba
Terapii je možno rozdělit na symptomatickou (léčbu spasticity, sfinkterových poruch, bolesti, depresí apod.) a imunosupresivní/ imunomodulační. Z jiného pohledu se rozlišuje léčba ataky (v jakémkoli stadiu nemoci) a léčba dlouhodobá, s cílem oddálení progrese choroby.
V terapii akutní ataky, která by měla být zahájena co nejdříve, se užívají především pulzní dávky kortikoidů. Dalšími možnostmi je podání intravenózních imunoglobulinů a plazmaferéza [5].
Dlouhodobou léčbu indikuje, řídí a také ukončuje (po dosažení přesně daných kritérií) specializované centrum. Tato imunomodulační léčba (DMD – disease- -modifying drugs) má za cíl zjednodušeně řečeno utlumit IS, a tím snížit patologickou autoimunitní aktivitu organizmu. Současně však také může snižovat jeho schopnost bránit se infekčním chorobám (viz dále) [3,5].
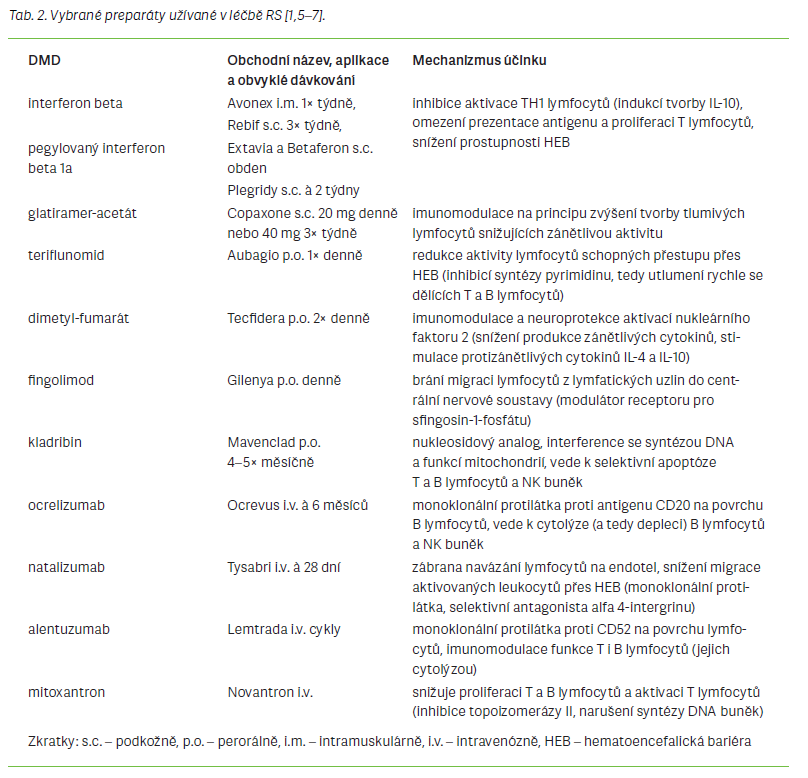
První léčebnou linii tvoří následující preparáty: interferon beta, glatiramer-acetát, terifl unomid a dimetyl- -fumarát. Mají různé aplikační formy, frekvenci podávání a tolerabilitu (nežádoucí účinky zahrnují flu-like syndrom, kožní reakce, hepatotoxicitu aj.).
V případě jejich neúspěchu se používají léčiva ze skupiny modulátorů sfi ngosin-1-fosfát (S1P) receptorů (fi ngolimod, siponomod), kladribin, natalizumab, protilátka proti CD20 rituximab nebo alentuzumab. Pokud ani ty nejsou účinné, je indikována léčba mitoxantronem nebo cyklofosfamidem [3]. Některé dostupné léky, jejich dělení, mechanizmus účinku a dávkování uvádějí souhrnně tab. 1 a 2.
 Dělení očkovacích látek
Dělení očkovacích látek
Neživé (inaktivované) vakcíny
Inaktivované vakcíny obsahují usmrcený virus, bakterii nebo jen jejich části. Pro imunitní systém představují slabší stimul, základní očkovací schéma často mívá více dávek nebo se musí v určitých intervalech přeočkovávat. Ke zvýšení imunogenity se někdy užívají přídatné látky (adjuvans), např. hlinité soli nebo se antigen váže na další substanci (tzv. konjugace). Tradičně se neživé vakcíny dělí na celobuněčné, subjednotkové, polysacharidové, štěpené, konjugované, rekombinantní (antigen vakcíny je syntetizován mikroorganizmem, např. kvasinkou) a toxoidy.
Novější přístupy v přípravě očkovacích látek reprezentují DNA vakcíny, mRNA vakcíny nebo bio syntetické vakcíny, které jsou vyrobeny uměle a svým tvarem i vlastnostmi napodobují infekční mikroorganizmus [8]. Vektorové vakcíny využívají jako nosič genetické informace pro žádaný antigen jiný virus (usmrcený nebo alespoň zbavený možnosti replikovat se) [9].
Živé atenuované vakcíny
Tyto očkovací látky obsahují oslabený virus nebo bakterii, které nemohou vyvolat onemocnění, ale více napodobují přirozený infekční proces. Po živých vakcínách proto bývá většinou silná a dlouhodobá ochrana [10].
Jsou kontraindikovány u těhotných žen a u jedinců s vážnou poruchou imunity (u nichž je vinou špatně fungujícího IS přece jen jisté riziko vyvolání nemoci, proti které je jedinec očkován).
K atenuovaným vakcínám s injekční aplikací se řadí očkovací látka proti žluté zimnici (Stamaril), proti spalničkám, zarděnkám, příušnicím, neštovicím a tuberkulóze (BCG). K perorálně podávaným živým vakcínám patří např. obě v ČR dostupné vakcíny proti rotavirům a vakcína proti břišnímu tyfu (Vivotif).
Pro slizniční (nosní) podání je ve světě dostupná např. živá vakcína proti chřipce (tzv. LAIV – live att enuated infl uenza vaccine) [11].
Problematika očkování u nemocných s roztroušenou sklerózou
Vědecké práce o očkování u pacientů s RS mají obecně dvě hlavní témata: účinnost očkování u pacientů užívajících imunosupresivní/ DMD léčbu a eventuální vztah k nově vzniklým atakám RS po očkování.
Efektivita některých vakcín při současně podávané imunomodulační léčbě při RS byla hodnocena mnoha studiemi. Většinou se však jedná o poměrně malé soubory pacientů (desítky), ně kte ré ze studií nebyly randomizované a zaslepené. Hodnotily účinnost vakcinace při srovnávání různých léčiv mezi sebou, resp. jednoho léčiva proti placebu nebo proti zdravým kontrolám.
Rámcově lze (na základě závěrů z výzkumu vybraných preparátů) shrnout, že [12]:
• pacienti léčení interferonem beta prokázali dostatečnou imunitní odpověď na testované vakcíny (neživá vakcína proti chřipce, vakcína kombinující očkování proti tetanu, černému kašli a záškrtu, pneumokoková polysacharidová vakcína a meningokoková konjugovaná vakcína);
• užívání glatiramer-acetátu snižovalo imunitní odpověď na očkování neživou vakcínou proti chřipce;
• léčba teriflunomidem vedla k séroprotekci při očkování neživou vakcínou proti chřipce a proti vzteklině, ale protilátky dosahovaly nižších hodnot ve srovnání se zdravými kontrolami;
• léčba dimetyl-fumarátem neovlivňuje ani T lymfocyty zprostředkovanou, ani protilátkovou imunitu;
• fingolimod snižuje imunitní odpověď na očkování proti chřipce i proti tetanu (přesto většina pacientů dosáhla protektivních hodnot);
• u natalizumabu studie naznačují, že imunizace proti chřipce nevede k adekvátní imunitní odpovědi;
• pacienti užívající alentuzumab si během léčby udrželi protilátky proti tetanu a záškrtu (po předchozím očkování). Byla také prokázána dobrá T-dependentní i T-independentní imunita. Nicméně pacienti, kteří byli očkování až 6 měsíců po ukončení léčby alentuzumabem, dosáhli lepší imunitní odpovědi.
Problematikou bezpečnosti vakcín u nemocných s RS, včetně vakcinace jako možného spouštěče RS, se také zabývala řada výzkumů, většinou však sledovaný soubor zahrnoval max. desítky pacientů. Mnohé práce měly vzájemně rozporné výsledky [13].
Neoddiskutovatelným argumentem ve prospěch vakcinace je, že bakteriální a virové infekce obecně zhoršují RS a mohou ohrožovat život těch pacientů, kteří jsou léčeni imunosupresivní nebo imunomodulační léčbou. Proto je prevence nemocí, tedy očkování, obecně doporučena a její přínos převažuje nad případnými riziky.
Na základě práce uveřejněné v časopisu Frontiers of Immunology, která shrnula data získaná v desítkách studií na téma RS, jejich léčebných možností a očkování, lze říci následující [13]:
• není důkaz o tom, že by existoval příčinný vztah mezi vznikem nebo zhoršením RS a vakcinací proti spalničkám, zarděnkám, příušnicím, chřipce, žloutence typu A a B, lidským papilomavirům, záškrtu, tetanu, acelulární pertussi a meningokokům;
• adjuvans ve vakcínách nepředstavuje vyšší riziko rozvoje RS;
• očkování proti žluté zimnici může vyvolat relaps RS (viz však dále);
• inaktivované vakcíny nepředstavují riziko pro imunosuprimované pacienty, jejich efektivita může být nižší v závislosti na použitém léčivu a typu vakcíny;
• živé vakcíny jsou kontraindikovány při současné imunosupresivní léčbě;
• ideální načasování očkování je ještě před zahájením imunosupresivní/ DMD léčby: neživé vakcíny alespoň dva týdny předem, živé min. čtyři týdny předem;
• refrakterní perioda imunitního systému po vysazení imunosupresivní léčby může trvat až rok;
• účinnost vakcinace během zavedené léčby lze kontrolovat sérologicky;
• zejména u pacientů, u nichž je v plánu léčba fi ngolimodem nebo alentuzumabem, je vhodné naočkování proti lidským papilomavirům (je hlášen vyšší výskyt genitálních bradavic a cervikálních dysplazií v rámci surveillance těchto léčiv).
Jak bylo uvedeno výše, očkování proti žluté zimnici se standardně u pacientů s RS neprovádí. Toto doporučení vychází mj. ze studie provedené v roce 2011, která prokázala zvýšenou incidenci relapsů RS po očkování proti žluté zimnici [14]. Je však třeba podotknout, že zkoumaný soubor zahrnoval pouze 7 pacientů.
Švýcarská studie uveřejněná v roce 2020 ukázala pravý opak [15]. Po pečlivém uvážení byla 23 pacientům s RS (z nichž 10 bylo v tu chvíli léčeno DMD, 8 z nich natalizumabem) aplikována živá atenuovaná vakcína proti žluté zimnici (Stamaril). Pouze u jediného pacienta byl v období do 90 dní po očkování prokázán relaps nemoci. U tří dalších došlo k relapsu do roku po očkování, což však nelze dávat do souvislosti. V roce, který očkování Stamarilem předcházel, mělo 9 z 23 sledovaných pacientů dohromady celkem 12 relapsů (bez souvislosti s jakýmkoli očkováním).
Tato výzkumná práce tedy neprokázala zvýšené riziko relapsu po očkování proti žluté zimnici u pacientů s RS, a to ani těch léčených DMD.
Závěr
Užívání imunosupresivních a imunomodulačních léčiv může snížit imunitní odpověď na podané očkovací látky. Proto by pacienti měli být naočkováni ideálně ještě před zahájením této léčby nebo by měla být ověřena hladina protilátek v krvi. Pacienti se ale mohou očkovat i v jejím průběhu. V současné době není potvrzeno, že by očkování neživými vakcínami mělo souvislost s novou atakou nebo zhoršením průběhu RS.
Živé vakcíny se obecně nepodávají u pacientů na imunosupresivní/ imunomodulační léčbě. Proto by mělo být ověření přítomnosti protilátek zejména proti spalničkám a neštovicím provedeno ještě před zvažovanou DMD, kdy je aplikace živé vakcíny možná.
Zatím panuje konsenzus, že by očkování proti žluté zimnici nemělo být u pacientů s RS prováděno vůbec (bez ohledu na užívanou léčbu). Výše zmíněná švýcarská práce z roku 2020, naznačující naopak bezpečnost této vakcinace, dokládá, že je na tomto poli třeba dalšího výzkumu, ideálně na velkých souborech pacientů s RS.
Na tomto místě bychom ještě rádi zdůraznili důležitost kolektivní imunity (tedy dostatečné proočkovanosti populace proti ně kte rým nákazám, zejména chřipce, spalničkám, neštovicím, černému kašli a pneumokokům), která pak před onemocněním chrání také jedince, kteří naočkováni být nemohou nebo jejichž imunitní systém se není schopen dostatečně účinně bránit.
Literatura
1. Vališ M, Pavelek Z et al. Roztroušená skleróza pro praxi. 2. vyd. Praha: Maxdorf 2020.
2. Multiple Sclerosis Discovery Forum. More than meets the yey. 2021 [online]. Dostupné z: http://www.msdiscovery.org/news/news_ synthesis/322-more-meets-eye.
3. Klinický doporučený postup pro dia gnostiku a léčbu roztroušené sklerózy a neuromyelitis optika a onemocnění jejího širšího spektra. 2020 [online]. Dostupné z: htt ps:/ / www.czech-neuro. cz/ content/ uploads/ 2020/ 04/ rs_odborna-2.0_fi nal_pub_web-2.pdf.
4. Vaněčková M, Seidl Z. Roztroušená skleróza a onemocnění bílé hmoty v MR zobrazení. Praha: Mladá fronta 2018.
5. Kaňovský P, Bártková A. Speciální neurologie. Svazek II. Olomouc: Univerzita Palackého v Olomouci 2020.
6. Multiple Sclerosis Trust. Mitoxantron (Novantron). 2017 [online]. Dostupné z: https://mstrust.org.uk/a-z/mitoxantrone-novantrone.
7. El-Feky M, Gaillard F. Multiple sclerosis. Radiology Reference Article. 2020 [online]. Dostupné z: https://radiopaedia.org/articles/multiple-sclerosis.
8. Gunasekaran B, Gothandam KM. A review on edible vaccines and their prospects. Braz J Med Biol Res 2020; 53(2): e8749. Doi: 10.1590/ 1414-431x20198749.
9. Balakrishnan VS. The arrival of Sputnik V. Lancet Infect Dis 2020; 20(10): 1128. doi: 10.1016/ S1473-3099(20)30709-X.
10. Chlíbek R. Očkování dospělých. 2. vyd. Praha: Mladá fronta 2019.
11. Live Att enuated Infl uenza Vaccine [LAIV] (The Nasal Spray Flu Vaccine). 2021 [online]. Dostupné z: htt ps:/ / www.cdc. gov/ fl u/ prevent/ nasalspray.htm.
12. Ciott i JR, Valtcheva MV, Cross AH. Eff ects of MS disease- -modifying therapies on responses to vaccinations: a review. Mult Scler Relat Disord 2020; 45: 102439. doi: 10.1016/ j.msard.2020. 102439.
13. Zrzavy T, Kollaritsch H, Rommer PS et al. Vaccination in multiple sclerosis: friend or foe? Front Immunol 2019; 10: 1883. doi: 10.3389/ fi mmu.2019.01883.
14. Farez MF, Correale J. Yellow fever vaccination and increased relapse rate in travelers with multiple sclerosis. Arch Neurol 2011; 68(10): 1267–1271. doi: 10.1001/ archneurol.2011.131.
15. Hutt ner A, Eperon G, Lascano AM et al. Risk of MS relapse aft er yellow fever vaccination: a self-controlled case series. Neurol Neuroimmunol Neuroinfl amm 2020; 7(4): e726. doi: 10.1212/ NXI.0000000000000726.
MUDr. Eva Pernicová, MBA
Centrum Očkování a cestovní medicíny Avenier
Netroufalky 5/ 797
625 00 Brno-Bohunice

