Historie očkování proti HPV asociovaným nemocem
T. Fait
Gynekologicko-porodnická klinika 2. LF UK a FN Motol
 Úvod
Úvod
Zavedení vakcinace proti lidským papilomavirům (HPV – human papil loma virus) do praxe v roce 2006 přineslo obecné zvýšení zájmu o tuto pohlavně přenosnou infekci. Do povědomí laické i odborné veřejnosti se dostala informace, že HPV je pohlavně přenosná infekce s vysokou prevalencí, která při své perzistenci ohrožuje muže, ženy i děti. Po 10 letech od začátku očkování se do klinické praxe dostává nonavalentní vakcína, která významně rozšiřuje účin nost vakcinace a má již i populační data potvrzující její smysl a bezpečnost.
Od objevení HPV v roce 1907 uplynulo více než půl století, než bylo v letech 1974–1984 prokázáno prof. Zur Hausenem kauzální spojení mezi HPV infekcí a karcinomem hrdla děložního, za což v roce 2008 získal Nobelovu cenu. Znalost zmíněné kauzální souvislosti byla podkladem k vývoji vakcín proti HPV, které byly v roce 2006 (kvadrivalentní vakcína Silgard®, HPV 6/11/16/18), 2007 (bivalentní vakcína Cervarix®, HPV 16/18) a 2015 (nonavalentní vakcína Gardasil®9, HPV 6/11/16/18/31/33/45/52/58) uvedeny do klinického užívání, a k doporučení Světové zdravotnické organizace opřít případný nově zakládaný screen ing karcinomu hrdla děložního o detekci přítomnosti HPV.

Lidské papilomaviry
Z pohledu lidského zdraví má význam 40 typů, které infikují epitel kůže a sliznic, zejména anogenitální oblasti. Dle onkogenního potenciálu se dělí na vysoce rizikové (HR – high risk) a nízce rizikové (LR – low-risk) (tab. 1).
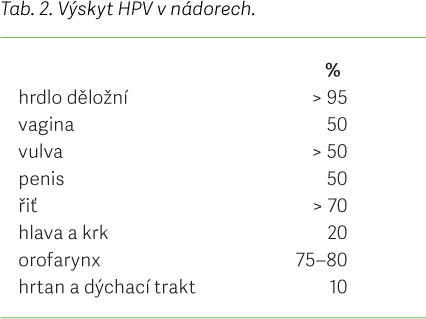
HR typy HPV jsou druhým nejvýznamnějším lidským karcinogenem po tabákovém kouři. Jsou ve vysokém procentu nalézány i v dalších nádorech (tab. 2).
Nejvnímavější k infekci je oblast přechodu dlaždicového a cylindrického epitelu (hrdlo děložní, anus, farynx), kde viry napadají nezralé keratinocyty, ke kterým pronikají přes mikrotraumata.
Přenos je prakticky možný výhradně sexuálním stykem, méně často z matky na dítě či pouhým kožním kontaktem.
Jedná se o nejčastější pohlavně přenosnou infekci s celoživotním rizikem infekce až 70 %, při prevalenci 14–40 % s maximem mezi 18. a 25. rokem. Naštěstí u 80 % in. kovaných dochází ke spontán nímu vymizení infekce. Za měsíc po infekci se aktivuje nejprve buněčná a později protilátková imunita, která se však vyvíjí pouze u 54–69 % in. kovaných. Perzistující (přetrvávající) infekce je spojena s klinickými projevy typickými pro jednotlivé skupiny HPV.
LR stejnou měrou postihují muže i ženy s celkem 30 mil. případů genitálních bradavic ročně a způsobují také rekurentní respirační papilomatózu. HR typy stojí celosvětově ročně za 0,5 mil. karcinomů hrdla děložního, 11 000 případů karcinomů penisu, významně se podílejí i na karcinomu řiti, vulvy, vaginy a karcinomech hlavy a krku [1].
Genitální bradavice (kondylomata)
Genitální bradavice jsou ve > 90 % způsobovány LR HPV typu 6 a 11. Jejich prevalence v populaci se pohybuje kolem 1 % [2] s mírným trvalým nárůstem. Přestože se jedná o benigní onemocnění, má významný vliv na kvalitu života pacientů kvůli významné tendenci k rekurenci. Náklady na léčbu genitálních bradavic v Anglii [3] jsou považovány za jeden z důvodů změny zvolené vakcíny v plošném očkování proti HPV ve Velké Británii v roce 2012 z bivalentní na kvadrivalentní.
Kvadrivalentní vakcína je určena k aplikaci dívkám a ženám ve věku 9–45 let a chlapcům a mužům ve věku 9–26 let. Vykazuje 100% (95% CI 92–100) účin nost proti kondylomatům způsobeným typy HPV 6 a 11 v HPV naivní populaci při dodržení očkovacího protokolu a 76% (95% CI 61–86) účin nost v běžné populaci [4].
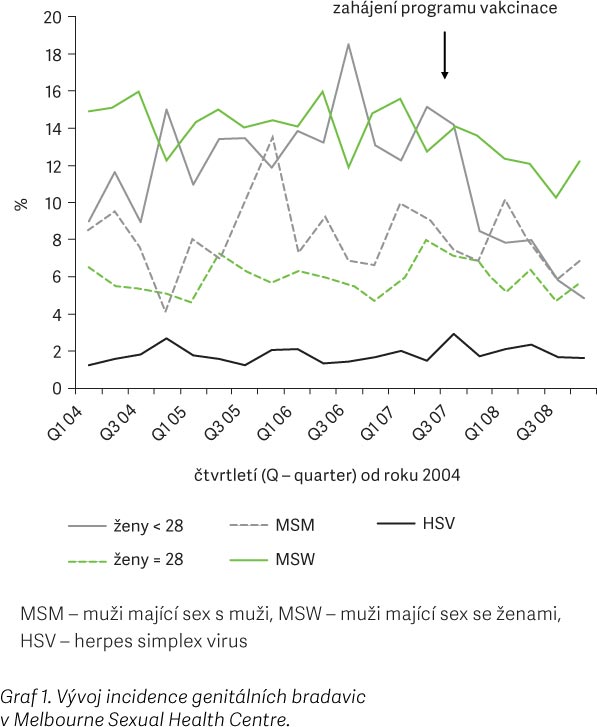
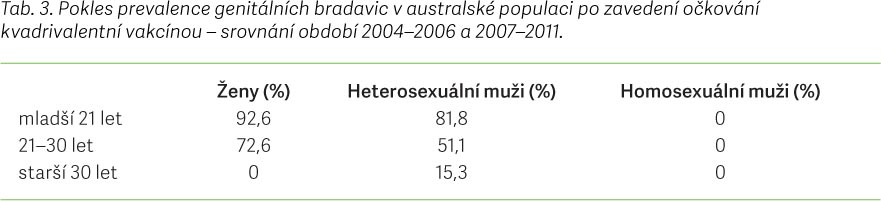
Při dostatečném pokrytí cílové populace dívek samozřejmě z tohoto očkování profitují i heterosexuální muži, jak ukazují data z Austrálie [5]. V Austrálii byl v roce 2007 zahájen školní očkovací program pro dívky ve věku 12–13 let, do konce roku 2009 se mohly zdarma očkovat kvadrivalentní vakcínou také dívky ve věku 13–18 let a v komunitním systému i ženy ve věku 18–26 let. Bylo dosaženo pokrytí 83 % cílové populace. Již po roce od zahájení očkování byl sledován významný pokles případů genitálních bradavic nejen u dívek, ale i u heterosexuálních mužů (graf. 1), vedoucí až k praktickému vymizení genitálních bradavic u očkovaných žen po 3 letech od zahájení očkování (tab. 3) [6].
Dvoudávková očkovací schémata
Na základě výsledků studií hodnotících imunitní odpověď a bezpečnost dvoudávkového schématu v populaci ve věku 9–13 let (kvadrivalentní vakcína), resp. 9–14 let (bivalentní vakcína) je u těchto vakcín schváleno i dvoudávkové schéma aplikace. Imunitní odpověď u jedinců v uvedeném věku po dvou dávkách není horší než po třech dávkách u starší populace dívek ve věku 15 (16) až 25 (26) let a kvalita imunitní odpovědi je srovnatelná s třídávkovým schématem. Bezpečnostní profil je stejný jako u třídávkového schématu.
Dvoudávkové schéma přispělo ke zvýšenému zájmu o HPV očkování v kohortě 13letých dívek. Dvoudávkové očkovací schéma u adolescentů je schváleno i pro nonavalentní vakcínu Gardasil®9 (lze aplikovat až do 14 let vč. v době podání první dávky).
Nonavaletní vakcína
V nonavalentní vakcíně byl navýšen počet onkogen ních typů o dalších pět, konkrétně o HPV 31/33/45/52/58 typy. Nonavalentní vakcína může zvýšit potenciál prevence dosažený bivalentní, resp. kvadrivalentní vakcínou ze 70 na 90 % pro karcinom hrdla děložního, navíc pokrývá 85–95 % karcinomů závislých na HPV z oblasti vulvy, vaginy a anu. Účin nost proti lézím spojeným s HPV 31/33/45/52/58 je 97 %.
Přestože platí, že efekt vakcinace je nejvyšší v době před zahájením pohlavního života, z vakcinace mohou pro. tovat i ženy a muži již sexuálně aktivní [7].
Vyvrácené obavy
V průběhu 10 let klinických zkušeností s očkováním nebyl prokázán zvýšený výskyt neurodegenerativních a autoimunitních chorob, které jsou častým argumentem odpůrců všech očkování.
Dle dostupných údajů není těhotenství očkováním ohroženo (během vývojového programu s vakcínou Silgard® uvedlo 3 819 žen alespoň jedno těhotenství), ale vzhledem k neexistenci studií doporučujeme očkování při známém těhotenství odložit. Ve studiích fertility prováděných na zvířatech nebyly zjištěny žádné přímé nebo nepřímé účinky na reprodukci. Rovněž při kojení nebylo zjištěno vyšší ohrožení kojence ve srovnání s placebem.
Další sledování z Austrálie popisují prakticky vymizení genitálních bradavic ve věkové kohortě očkovaných [8] a tento trend potvrzují i studie z Belgie [9], Švédska [10] či Kalifornie [11]. Četné národní studie z Austrálie, USA, Kanady či severní Evropy prokazují již také pokles počtu cervikálních lézí nižších stupňů [12–15] a prevalence HPV infekce v populaci [16–19].
Závěr
Očkování proti HPV za 10 let v klinické praxi prokázalo svoji bezpečnost. Prokázalo také svoji účin nost v očkované populaci nejen v oblasti genitálních bradavic, ale i cervikálních lézí a prevalence HPV infekce obecně.
Je v podstatě jen otázkou času, kdy se podobná data ukáží i ve výskytu HPV asociovaných nádorových lézí všech lokalizací.
Pro adolescenty jsou pro všechny tři existující vakcíny schválena dvoudávková očkovací schémata, což významně zlevňuje očkovací programy.
Většina očkovacích programů preferuje současnou ochranu i proti LR HPV (6, 11) typům, resp. jejich projevům.
Kvalitativní skok pak znamená i zavedení nonavalentní vakcíny, která rozšiřuje pokrytí prevence dosažené bivalentní, resp. kvadrivalentní vakcínou ze 70 na 90 % pro karcinom hrdla děložního a navíc pokrývá 85–95 % karcinomů závislých na HPV z oblasti vulvy, vaginy a řiti.
V parafrázi úspěšné knihy posledních měsíců mi dovolte závěrem uvést, o čem sním jako klinický lékař:
- vyhlášení srovnatelné úhrady všech vakcín v kohortové skupině, tedy možnost doplatit si na nonavalentní vakcínu rozdíl ceny;
- uplatnění genderové rovnosti pro chlapce v oblasti očkování proti HPV;
- dosažení 80% proočkovanosti kohorty navzdory dezinformačním aktivitám různých iracionálních skupin.
Literatura
1. European Centre for Disease Prevention and Control: Introduction of HPV vaccines in EU countries – an update. Stockholm: ECDC 2012: 1–40. doi: 10.2900/60814.
2. Fait T, Dvořák V, Skřivánek A et al. Epidemiologie genitálních bradavic mezi ženami v České republice. Ceska Gynekol 2012; 77(4): 360–363.
3. Desai S, Wetten S, Woodhall SC et al. Genital warts and cost of care in England. Sex Transm Infect 2011, 87(6): 464–468. doi: 10.1136/sti.2010.048421.
4. Garland SM, Hernandez-Avila M, Wheeler CM et al. Quadrivalent vaccine against human papillomavirus to prevent anogenital disease. N Engl J Med 2007; 356(19): 1928–1943.
5. Fairley CK, Hocking JS, Gurrin LC et al. Rapid decline in presentation of genital warts aft er the implementation of a national quadrivalent human papillomavirus vaccination programme for young women. Sex Transm Infect 2009; 85(7): 499–502. doi: 10.1136/sti.2009.037788.
6. Gertig DM, Brotherton JM, Saville M. Measuring human papillomavirus (HPV) vaccination coverage and the role of the National HPV Vaccination Program Register, Australia. Sex Health 2011; 8(2): 171–178. doi: 10.1071/SH10001.
7. Fait T, Dvořák V, Pilka R. Nonavalentní HPV vakcína – nová generace očkování proti HPV. Ceska Gynekol 2015; 80(6): 397–400.
8. Read TR, Hocking JS, Chen MY et al. The near disappearance of genital warts in young women 4 years after commencing a national human papillomavirus (HPV) vaccination programme. Sex Transm Infect 2011; 87(7): 544–547. doi: 10.1136/sextrans-2011-050234.
9. Dominiak-Felden G, Gobbo C, Simondon F. Evaluating the early bene.t of quadrivalent HPV vaccine on genital warts in Belgium: a cohort study. PLoS One 2015; 10(7): e0132404. doi: 10.1371/journal.pone.0132404.
10. Leval A, Herwe.er E, Arnheim-Dahlström L et al. Incidence of genital warts in Sweden before and after quadrivalent human papillomavirus vaccine availability. J Infect Dis 2012; 206(6): 860–866. doi: 10.1093/infdis/jis405.
11. Bauer HM, Wright G, Chow J. Evidence of human papillomavirus vaccine e.ectiveness in reduc ing genital warts: an analysis of California public family planning administrative claims data, 2007–2010. Am J Public Health 2012; 102(5): 833–835. doi: 10.2105/AJPH.2011.300465.
12. Brotherton JM, Fridman M, May CL et al. Early effect of the HPV vaccination programme on cervical abnormalities in Victoria, Australia: an ecological study. Lancet 2011; 377(9783): 2085–2092. doi: 10.1016/S01406736(11)60551-5.
13. Powell SE, Hariri S, Steinau M et al. Impact of human papillomavirus (HPV) vaccination on HPV 16/18-related prevalence in precancerous cervical lesions. Vaccine 2012; 31(1): 109–113. doi: 10.1016/j.vaccine.2012.10.
092.
14. Gertig DM, Brotherton JM, Budd AC et al. Impact of a population-based HPV vaccination program on cervical abnormalities: a data linkage study. BMC Med 2013; 11: 227. doi: 10.1186/1741-7015-11-227.
15. Baldur-Felskov B, Dehlendor. C, Junge J et al. Incidence of cervical lesions in Danish women before and after implementation of a national HPV vaccination program. Cancer Causes Control 2014; 25(7): 915–922. doi: 10.1007/s10552-014-0392-4.
16. Tabrizi SN, Brotherton JM, Kaldor JM et al. Fall in human papil lomavirus prevalence fol low ing a national vaccination program. J Infect Dis 2012; 206(11): 1645–1651. doi: 10.1093/infdis/jis590.
17. Markowitz LE, Hariri S, Lin C et al. Reduction in human papillomavirus (HPV) BMC Infect Dis. prevalence among young women following HPV vaccine introduction in the United States, National Health and Nutrition Examination Surveys 2003–2010. J Infect Dis 2013; 208(3): 385–393. doi: 10.1093/infdis/ jit192.
18. Deleré Y, Remschmidt C, Leuschner J et al. Human papillomavirus prevalence and probable . rst e.ects of vaccination in 20 to 25 year-old women in Germany: a population-based cross-sectional study via home-based self-sampling. BMC Infect Dis 2014; 14: 87. doi: 10.1186/1471-2334-14-87.
19. Markowitz LE, Liu G, Hariri S et al. Prevalence of HPV after introduction of the vaccination program in the United States. Pediatrics 2016; 137(3): e20151968. doi: 10.1542/peds.2015-1968.
doc. MUDr. Tomáš Fait, Ph.D.
Gynekologicko-porodnická klinika
2. LF UK a FN Motol V Úvalu 84, 150 06 Praha 5

