Zoonózys uzlinovým syndromem
L. Hozáková
Klinika infekčního lékařství, Fakultní nemocnice Ostrava
Souhrn
K zoonózám, které se vyskytují na našem území a projevují se uzlinovým syndromem, se řadí nemoc z kočičího škrábnutí, toxoplazmóza a tularemie. Základem diagnostiky je sérologické vyšetření. Histologickým nálezem je granulomatózní zánět, u nemoci z kočičího škrábnutí a tularemie event. v kombinaci s abscedujícím a nekrotickým zánětem.
Klíčová slova
uzlinový syndrom – nemoc z kočičího škrábnutí – toxoplazmóza – tularemie
Úvod
Uzlinový syndrom je termín pro patologické zvětšení uzlin infekční a neinfekční etiologie. Z infekční etiologie jsou nejčastější příčinou uzlinového syndromu běžné virové a bakteriální infekce horních cest dýchacích (bakteriální tonzilitida, Epstein-Barrové virus a cytomegalovirus), které převažují nad jinými příčinami lymfadenopatie. Po vyloučení běžných příčin uzlinového syndromu se v rámci diferenciální diagnostiky uzlinového syndromu pomýšlí na méně častá infekční onemocnění, a to v našich podmínkách na nemoc z kočičího škrábnutí, toxoplazmózu a tularemii. Uzlinový syndrom se vyskytuje vzácně také u atypické mykobakteriózy, uzlinové formy tuberkulózy a HIV infekce. Z importovaných nákaz bývá uzlinový syndrom u brucelózy, viscerální leishmaniózy a lymfogranuloma venereum [1–3]. Uzlinový syndrom neinfekční etiologie může mít autoimunitní příčinu (systémový lupus erythematodes, Sjögrenův syndrom), může se jednat o vrozené metabolické nemoci (Niemann-Pickova, Gaucherova nemoc), hypersenzitivní reakci na užívání medikamentů (alopurinol, atenolol, sulfonamidy, karbamazepin, izoniazid) nebo vzniká po vakcinaci či aplikaci imunoglobulinů (vakcína proti tuberkulóze BCG, sérová nemoc). Příčinou uzlinového syndromu mohou být další vzácné nemoci, jako je Kawasakiho mukokutánní uzlinový syndrom, dermatopatická lymfadenopatie nebo Kikuchiho histiocytová nekrotizující lymfadenitida [4]. V neposlední řadě může být etiologie uzlinového syndromu maligní (akutní a chronické leukémie, lymfomy, maligní histiocytóza X, metastázy karcinomů a sarkomů) [4,5]. Diferenciální diagnostika uzlinového syndromu je široká, tento text se následně zabývá zoonózami s uzlinovým syndromem, které se vyskytují na našem území, a to nemocí z kočičího škrábnutí, toxoplazmózou a tularemií.
Nemoc z kočičího škrábnutí
Nemoc z kočičího škrábnutí je způsobena bakterií Bartonella henselae, vzácně Bartonella claridgeiae [6]. Nejvýznamnějším rezervoárem B. henselae jsou kočky, zejména koťata a kočky do 1 roku, které se pohybují venku [7]. Vektorem přenosu Bartonelly mezi kočkami a u dalších zvířecích rezervoárů je blecha kočičí Ctenocephalides felis. Většina koček nemá známky nemoci [8]. Bartonelly, které se vyskytují v erytrocytech kočky, se po nasátí blechou množí v zažívacím traktu blechy a pak se trusem dostávají na srst kočky. Při úpravě srsti si kočka zanese trus na drápky, zuby a do slin [6]. Člověk se nakazí po poškrábání, pokousání nebo při lízání ran kočkou. Protože Bartonella zůstává životaschopná v trusu blechy min. 15 dní, pro infi kování člověka stačí pobyt v prostředí infi kovaných blech kočičích. V tomto případě může B. henselae proniknout z prostředí přes porušený kožní kryt i bez poranění kočkou [9,10]. Z rezervoárových zvířat může bakterii B. henselae přenášet na člověka i klíště Ixodes ricinus a klíšťata rodu Dermacentor a v poslední době se uvádí jako vektor přenosu na člověka i blecha kočičí [11–13].
Klinický obraz
Za 3–10 dní po poškrábání, pokousání kočkou nebo po inokulaci patogenu do jiným způsobem poraněné kůže se v místě vstupu patogenu objeví erytémové papuly, které se mohou měnit přes vezikuly a pustuly v krusty. U našich pacientů jsme tyto morfy pozorovali jen u 20 % ze 73 pacientů [14]. Tyto morfy přetrvávají 3 týdny až několik měsíců [14]. Během 1–3 týdnů se v typickém případě rozvíjí regionální lymfadenitida, která může přetrvávat několik týdnů až měsíců [15]. Někteří autoři uvádí, že se asymetrická lymfadenopatie objeví nejčastěji v axile a epitrochleárně (46 %), na krku (26 %) a v třísle (18 %) [16]. Na naší klinice jsme pozorovali častěji postižené uzliny v krční oblasti (44 %) a následně v axilární oblasti (33 % pacientů) [14]. Postižené uzliny mohou být značného rozsahu, až 5_cm v průměru [17]. Kolem uzlin bývá otok měkkých tkání a uzliny bývají většinou bolestivé a volně pohyblivé proti kůži. Kůže nad uzlinou může být zarudlá až nafialovělá [17]. Přibližně u 10–15 % pacientů dochází k abscesu v uzlině a někdy může dojít i k vytvoření píštěle [17]. U typického průběhu nemoci s lymfadenitidou mohou být i lehké systémové příznaky. Horečka se vyskytuje u 30–60 % pacientů, únava a nauzea u 25 %, bolesti hlavy a krku u 10 % pacientů [17]. Laboratorně může být zvýšen C-reaktivní protein a elevované aminotransferázy [17]. Průběh onemocnění závisí do značné míry na imunologickém stavu pacienta. U imunokompetentních pacientů onemocnění může probíhat inaparentně, ale častěji probíhá typicky jako uzlinový syndrom. Tento průběh je pozorován u přibližně 85–90 % pacientů, u zbývajících pacientů probíhá atypicky s postižením různých orgánů [17].
Atypický průběh onemocnění se může manifestovat postižením oka, jater, srdce, centrálního nervového systému, hnisavým zánětem kostí, vaskulitidou, někdy bez zvětšení periferních uzlin [18]. U imunokompromitovaných pacientů může onemocnění probíhat jako bacilární angiomatóza s postižením různých orgánů nebo pelióza s postižením jater a sleziny [19].
Diagnostika
Diagnóza uzlinového syndromu je založena zejména na sérologických testech. Používá se metoda nepřímé imunofluorescence (IF) a enzymová imunoanalýza ELISA. Pozitivita imunoglobulin M (IgM) protilátek svědčí pro akutní onemocnění, ale protože IgM protilátky přetrvávají krátkou dobu, až u 50 % pacientů nemusí být zachyceny. Protilátky třídy IgG přetrvávají většinou 22–28 týdnů, ale u 25 % pacientů přetrvávají přes 1 rok, což limituje klinickou hodnotu tohoto testu [20]. Výsledky sérologie mohou být falešně negativní, ale i falešně pozitivní [20]. Další metodou je polymerázová řetězová reakce (PCR – polymerase chain reaction). Senzitivita této metody je nižší než u sérologie, dosahuje jen 43–76 %, ale specifi cita je téměř 100 % [20]. Metoda PCR může pomoci odhalit B. henselae zejména u pacientů s atypickou manifestací [21]. Touto PCR metodou byla prokázána B. henselae i v nehojící se morfě po poškrábání kočkou [22]. PCR diagnostika na průkaz B. henselae se u nás provádí jen v některých pracovištích (např. Bioptická laboratoř Plzeň, SZÚ Praha, CGB laboratoř Ostrava v rámci grantu). Protože je B. henselae intracelulární bakterie, její kultivace je málo úspěšná. Sonograficky bývají uzliny četnější, hypoechogenní a značně vaskularizované a v důsledku otoku bývá zvýšená echogenita měkké tkáně ohraničující uzlinu [16]. U nemoci z kočičího škrábnutí bývá při histologickém vyšetření zánět granulomatózní nebo jeho kombinace s nekrotickým či abscedujícím zánětem.
Terapie
Léčba nemoci z kočičího škrábnutí dosud není standardizovaná pro volbu antibiotika ani délku antibiotické léčby [23]. Za „účinná“ antibiotika se považují makrolidy, doxycyklin, rifampicin, ciprofloxacin, trimethoprim-sulfamethoxazol, gentamicin [24]. Většina antibiotik má však pouze bakteriostatický účinek na B. henselae, pouze aminoglykosidy mají baktericidní účinek. Přesto jsou lékem volby u lehčích průběhů makrolidy. Americká pediatrická společnost např. doporučuje jako lék první volby pro děti imunokompetentní či imunokompromitované s typickým i atypickým průběhem nemoci 5denní léčbu azithromycinem [25]. U dospělých pacientů nebo starších dětí lze zvolit i další makrolidy (např. klarithromycin) nebo tetracykliny po dobu 10– 14 dní [26]. Onemocnění se považuje za samoúzdravné, proto se názory na antibiotickou léčbu dosud rozchází. Důvodem je, že onemocnění odeznělo i při použití neúčinných antibiotik při empirické léčbě a také že ani účinná antibiotika nezabránila progresi zánětu uzliny v absces a neměla vliv na délku trvání nemoci [15]. Při neustupující lymfadenitidě, při které zvětšená uzlina přetrvává déle než 4 měsíce, by měla být uzlina odstraněna a histologicky vyšetřena [15]. U pacientů s abscedující lymfadenitidou se doporučuje aspirovat hnisavý obsah, což vede u bolestivých uzlin k úlevě a je šetrnější než exstirpace uzliny, po které může dojít k rozvoji lymfedému.
Prevence
Pacienti se sníženou imunitou by neměli mít kočku pocházející z útulku nebo z domácnosti, kde kočky pobíhají venku. Kočka by měla mít provedenu dezinsekci a neměla by se pohybovat venku, aby nedošlo k expozici blechám a jiným vektorům [17].
Toxoplazmóza
Toxoplazmóza je parazitární onemocnění způsobené prvokem Toxoplasma gondii. Biologický cyklus je charakterizován střídáním hostitele konečného, což je kočka a kočkovité šelmy, a mezihostitele, což je většina teplokrevných obratlovců vč. člověka [27]. Parazit ve střevě kočky prodělává pohlavní vývojový cyklus, jehož výsledkem jsou oocysty, které jsou vylučovány trusem do vnějšího prostředí, kde dozrávají během 3–4 dní [27]. Jsou rezistentní a vydrží v přírodě i déle než 1 rok [28]. Oocystami se nakazí býložraví savci a všežravci. Význam v udržení parazita v prostředí mají zejména drobní zemní savci, např. hraboš polní, u nichž probíhá intrauterinní šíření z generace na generaci [29]. Po pozření mezihostitele se opět nakazí kočka a kočkovité šelmy. Oocysty jsou vylučovány kočkou po určitou dobu, ale občas se vylučování může opakovat [28]. Studie na T. gondii ve vzorcích pocházejících ze Severní Ameriky a Evropy rozlišily 3 typy, a to typ I, II a III. Při použití metody 10 PCR-RFLP (polymorfizmus délky restrikčních fragmentů) bylo do roku 2012 odhaleno 189 genotypů. Vědci zjistili, že genotypy vyskytující se v Evropě (typ II, III) jsou signifikantně méně virulentní [30]. Genotypy vyskytující se v Jižní Americe způsobují těžké chorioretinitidy a atypické kmeny způsobují těžké akutní nebo diseminované onemocnění s život ohrožující pneumonií i u imunokompetentních pacientů [30]. Jedná se o kmeny, jejichž mezihostitelem je kapybara či pásovec a definitivním hostitelem jsou jiné kočkovité šelmy, např. jaguár, ocelot a další pralesní kočky [31]. Člověk se nakazí nejčastěji tkáňovými cystami konzumací nedostatečně tepelně zpracovaného masa, obzvláště ovčího, vepřového a králičího masa, nebo vodou či jídlem kontaminovaným oocystami, vzácně tachyzoity krevní transfuzí nebo požitím nepasterovaného mléka a mléčných výrobků [32]. Vzácně může dojít k nákaze kapénkovou infekcí, přes spojivkový vak, kožními oděrkami a transplacentárně z matky na plod [33]. V ČR se prevalence protilátek proti toxoplazmóze uvádí kolem 30 %, častěji onemocní muži, lidé na venkově, zaměstnanci jatek, chovatelé, veterináři a lidé konzumující s oblibou syrové maso [33]. V našem souboru 79 pacientů onemocněly častěji ženy (65 %) (nepublikováno).
Klinický obraz
Rozlišujeme prenatálně a postnatálně získanou toxoplazmózu [29]. Onemocnění probíhá asymptomaticky v 80–90 % případů [33]. Z klinických forem postnatálně získané toxoplazmózy je nejčastější uzlinová forma, která se u imunokompetentních osob projevuje lehce zvýšenou teplotou, únavou, myalgiemi a artralgiemi [27]. Vzácnější je oční forma toxoplazmózy. U imunokompromitovaných osob může mít onemocnění závažný průběh. Rovněž závažné následky může mít toxoplazmóza u těhotných žen.
U uzlinové formy mají postižené uzliny velikost hrášku, lískového ořechu nebo mandle, mají měkkou konzistenci, jsou nebolestivé, bez otoku v okolí uzliny, jsou volně pohyblivé. Kůže nad nimi nikdy není zarudlá a nikdy nedochází k hnisání. Uzliny se vyskytují na krku a šíji, v submandibulární oblasti, za ušním boltcem, na zadním okraji kývače. Mohou být zvětšeny i uzliny axilární, méně často tříselné [29,33]. Bývají častěji vícečetné a přetrvávají několik týdnů až měsíců [29]. Oční forma toxoplazmózy může být získaná, ale u části pacientů se může jednat o pozdní exacerbaci vrozené toxoplazmózy [29]. Projevuje se chorioretinitidou a má sklon k recidivám. Postnatálně získaná toxoplazmóza probíhá závažně u imunokompromitovaných pacientů a projevuje se jako mozková toxoplazmóza nebo jako generalizovaná forma s horečkami a postižením vnitřních orgánů [29]. Reaktivace latentní infekce se může projevit encefalitidou, myokarditidou a pneumonií [30]. Kongenitální toxoplazmóza je závažné onemocnění. Riziko přenosu infekce z matky na plod stoupá s pokročilostí gravidity, naopak nejzávažnější postižení plodu je v 1. trimestru. Ale i ve 2. trimestru může dojít k encefalitidě a očnímu postižení, kdežto ve 3. trimestru bývá postižení plodu nejmenší (chorioretinitida, protrahovaný ikterus) [34].
Diagnostika
Diagnostika je založena na sérologickém průkazu protilátek proti T. gondii. Základem je komplementfixační reakce (KFR) se stanovením celkové hladiny antitoxoplazmových protilátek všech tříd a metoda ELISA k průkazu protilátek třídy IgM, IgA, IgE a IgG. Avidita IgG protilátek se používá k odlišení akutní a odeznělé infekce. Čím déle trvá onemocnění, tím je silnější vazba antigen–protilátka, což se projevuje zvyšující se aviditou. Nízká avidita tedy svědčí pro akutní infekci a přetrvává většinou do 4 měsíců, ale i déle [35]. Většina laboratoří vyšetřuje protilátky třídy IgG a IgM a při pozitivitě IgM se došetřují protilátky třídy IgA a IgE a event. se provádí KFR. Rozlišujeme tři fáze infekce: akutní, postakutní a latentní.
Akutní fáze je charakteristická vzestupem KFR, pozitivitou protilátek třídy IgM, IgA a IgE a stoupající hladinou IgG protilátek následovanou vzestupem avidity IgG.
Postakutní fáze je typická stabilní nebo mírně klesající hodnotou KFR, protilátky IgA a IgE postupně vymizí, IgM může přetrvávat řadu měsíců až let. IgG jsou stabilní ve vysokých titrech s vysokou aviditou IgG.
Latentní fáze se vyznačuje nízkou hladinou IgG protilátek, vysokou aviditou IgG a negativní hodnotou protilátek třídy IgM, IgA a IgE [35].
Průkaz parazita metodou PCR z krve není vhodná metoda, protože parazit přetrvává v krvi jen krátkou dobu, proto negativní výsledek nevylučuje akutní onemocnění [36]. Použití PCR metody se doporučuje při vyšetření krve imunokompromitovaných pacientů, kde parazit přetrvává delší dobu, dále při vyšetření fetální krve, plodové vody, likvoru, oční tekutiny, tekutiny z bronchoalveolární laváže nebo exstirpované uzliny či jiného exstirpovaného materiálu, např. ložiska v mozku [36]. Komparativní imunoblot se používá u akutní toxoplazmózy v graviditě ke srovnání profilu protilátek ze séra matky a dítěte k posouzení vrozené toxoplazmózy [35]. Při histologickém vyšetření je typický granulomatózní zánět [30]. Izolační pokus na myši prokazuje živé tachyzoity ve vyšetřovaném materiálu.
Terapie
Pacienti s krční lymfadenitidou bez systémových známek onemocnění by měli být sledováni bez nutnosti antibiotické terapie [35]. Léčba uzlinového syndromu je indikovaná u dětí do 5 let věku cotrimoxazolem. Léčba oční formy toxoplazmózy, gravidních žen, vrozené toxoplazmózy a toxoplazmózy u imunokompromitovaných pacientů není předmětem sdělení.
Prevence
Nejvíce ohroženou skupinou jsou těhotné ženy a imunokompromitovaní pacienti, doporučuje se jim nekonzumovat a neochutnávat nedostatečně tepelně zpracované maso, nepít nepasterizované mléko, ovoce a zejména kořenovou zeleninu dostatečně očistit, dbát na hygienu rukou před jídlem. Těhotná žena by neměla přij ít do kontaktu s kočkou a jejím trusem. V rámci prevence by kočky neměly být krmeny syrovým masem [29]. Aby se zabránilo infekci malých dětí, měla by být pískoviště, pokud si v něm děti právě nehrají, chráněna před kontaminací kočičím trusem.
Tularemie
Tularemie je zoonóza známá také pod názvem „zaječí nemoc“. Poprvé byla popsána McCoyem v roce 1910 v Tulare v Kaliformii při studiu epidemie u populace syslů [37].
Původcem tularemie je fakultativně intracelulární gramnegativní bakterie [37]. Druh Francisella tularensis má čtyři poddruhy: F. tularensis subsp. tularensis (typ A), F. tularensis subsp. holarctica (typ B), F. tularensis subsp. mediasiatica a F. tularensis subsp. novicida. Bakterie F. tularensis subsp. tularensis (typ A) se vyskytuje v Severní Americe, ale několik kmenů bylo izolováno z prostředí členovců i na Slovensku a Rakousku [38]. F. tularensis subsp. holartica je rozšířena na celé severní hemisféře, zejména v Evropě a Asii, ale i v Tasmánii [38]. Zdrojem nákazy je široké spektrum hostitelů, které zahrnuje obratlovce a bezobratlé [37]. Malí hlodavci jsou k F. tularensis velmi vnímaví, onemocnění je často fatální. Zajíci jsou méně vnímaví, proto u nich onemocnění probíhá chronicky [39]. Středně vnímavá zvířata k F. tularensis, pokud patogen dlouho přetrvává v hostiteli, jsou zdrojem infekce pro člověka [39]. Tularemie u domácích zvířat, většinou u králíků, byla popsána i v ČR [37]. Jsou známy tři hlavní cesty přenosu infekce na člověka, a to při kontaktu se zvířaty, vektorem (klíště, komár, ovád, blecha) nebo požitím vody či půdy kontaminované trusem infikovaných zvířat [37]. Přímý přenos bývá při zpracování infikovaného zvířete, nejčastěji zajíce, konzumací nedostatečně tepelně zpracovaného masa infikovaných zvířat nebo kousnutím zvířetem, obzvláště malými hlodavci vč. veverky [38]. Ve střední Evropě mají hlavní roli v přenosu F. tularensis subsp. holarctica klíšťata a v severní Evropě komáři, což souvisí s rozšířením těchto členovců v uvedených oblastech. Ve vodě a půdě kontaminované infi kovanými hlodavci přetrvávají bakterie 3–5 měsíců [38]. V Norsku bylo popsáno více případů onemocnění požitím vody ze studny, která byla kontaminována mrtvými lumíky nebo jejich exkrety [39]. V posledních desetiletích se v ČR tularemie vyskytuje sporadicky, mezi hlavní ohniska patří jižní Morava a Polabí v západních Čechách [37]. Ohnisek epizoocie hlodavců je na území ČR mnohem více, tím se zvyšuje možnost nákazy člověka i mimo oblasti hlavního výskytu [37]. U tularemie je inkubační doba 1–2 týdny [37].
Klinický obraz
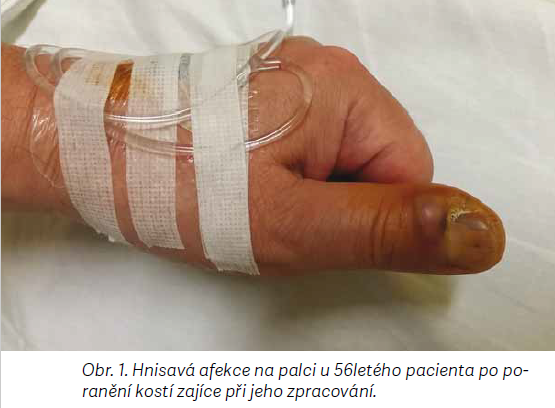
Závisí na vstupní bráně infekce, virulenci bakterie a na imunitním stavu pacienta. U lidí má onemocnění středně těžký až těžký průběh. Onemocnění začíná chřipkovitými potížemi vč. horečky, bolestmi hlavy, svalů a kloubů [37]. Má šest hlavních klinických forem závisejících na vstupu infekce. Nejčastější je ulceroglandulární forma vyznačující se drobnou hnisající ulcerací nebo jen pouhou infiltrací v místě poranění, poškrábání či bodnutí hmyzem a posléze se rozvíjí zduření regionálních uzlin, které mohou abscedovat nebo ulcerovat (obr. 1) [37].
Glandulární forma je podobná, jen chybí primární kožní léze.
Okuloglandulární forma vzniká při průniku patogenu přes oční spojivku při manipulaci se zvířetem, projevuje se bolestivou konjuktivitidou a preaurikulární lymfadenitidou. Jedná se o tzv. Parinaudův syndrom.
Oroglandulární forma vzniká po konzumaci masa z infikovaného zvířete, kontaminovaného jídla nebo vody. Projevuje se faryngitidou s krční lymfadenitidou. Abdominální forma vzniká při perorální nákaze, když se patogen po překonání žaludeční bariéry dostane do střeva. Projeví se celkovými příznaky a průjmem, někdy i s krví ve stolici a rozvojem mezenteriální lymfadenitidy.
Pneumonická forma je výsledkem vdechnutí F. tularensis kontaminovaným aerosolem s rozvojem bronchitidy nebo pneumonie s hilovou lymfadenitidou [40].
Generalizovaná forma (septická nebo tyfoidní forma) je v Evropě na rozdíl od USA vzácná. Projevuje se jako těžké systémové onemocnění s horečkou, bolestmi hlavy a svalů a neurologickými příznaky (zmatenost, stupor, poruchy chování), bez závislosti na vstupu infekce [39]. Při miliárním rozsevu může připomínat až tuberkulózu. Komplikací tularemie může být absces uzliny, měkkých tkání, otitis media, meningitida, mozkový absces a postižení dalších orgánů při hematogenním rozsevu (myokarditida, perikarditida, postižení ledvin a jater, osteomyelitida) [38]. Uvádí se poměrně častý výskyt kožních projevů – tularemidů. Ve 2. týdnu to bývá erupce typu erythema multiforme s maximem na předloktí a ve 3. týdnu erythema nodosum nejčastěji se objevující na bércích [37]. Až ve 30 % dochází k supuraci v uzlině nebo vzniku píštěle [37]. Průběh onemocnění je v Evropě méně závažný než v USA. V USA se častěji vyskytuje pneumonická a tyfoidní forma. Většina pneumonických forem se projevuje jako subakutní nebo chronická infekce s protrahovanou horečkou, kašlem, hmotnostním úbytkem, zvětšením mediastinálních uzlin, které připomínají tuberkulózu nebo lymfom či sarkoidózu [38].
Diagnostika
Diagnostika je založena na sérologickém průkazu protilátek proti F. tularensis aglutinační metodou s pozitivním titrem ≥1:80 nebo metodou ELISA. Specificita sérologických testů je vysoká, i když může být zkřížená pozitivita např. s Brucella spp. [38]. Protilátky proti F. tularensis mohou být prvních 7–14 dní po infekci negativní, proto je nutné vyšetření opakovat [37]. U jednoho našeho pacienta došlo k sérokonverzi až ve třetím odběru za 4 týdny od začátku nemoci (nepublikováno). Vrchol dosahují za 3–4 týdny od začátku onemocnění, pak protilátky prudce klesají, i když reziduální titry mohou přetrvávat měsíce až roky [38].
Kultivace je možná, ale vyžaduje speciální půdu s cysteinem. Při práci s infekčním materiálem hrozí riziko laboratorních nákaz [38]. Pro diagnózu tularemie v humánní medicíně je dostačující sérologický průkaz patogenu. PCR metoda je nadějná, umožňuje detekci DNA F. tularensis i v inaktivovaném vzorku pacientů, v rutinní praxi se u nás nepoužívá. Při histologickém vyšetření postižené tkáně bývá zánět granulomatózněnekroticko- abscedující [40].
Terapie
Antibiotická léčba je vždy indikována [37]. Terapeuticky se většinou doporučuje kombinace aminoglykosidu s doxycyklinem po dobu 7–14 dní, účinný je i ciprofloxacin a rifampicin.
Prevence
Doporučuje se opatrnost při manipulaci s divokými zajíci, nekonzumovat vodu v přírodě z nejasných zdrojů. Při pobytu v přírodě se doporučuje používat repelenty, které chrání i před dalšími patogeny, které jsou přenosné klíšťaty. Účinná vakcína proti F. tularensis zatím neexistuje, ale práce na jejím vývoji dále pokračuje [41].
Závěr
Pro diagnostiku uzlinového syndromu infekční etiologie má hlavní význam sérologické vyšetření, které může být doplněno dalšími metodami. Při nálezu granulomatózního zánětu v exstirpované uzlině by se mělo pomýšlet především na nemoc z kočičího škrábnutí, toxoplazmózu a tularemii.
Literatura
1. Macías A, Aguirre C, Bustamante A et al. Cat scratch disease in Medellín, Colombia. Oxf Med Case Reports 2014; 2014(3): 43–45. doi: 10.1093/ omcr/ omu018.
2. Nishio N, Kubota T, Nakao Y et al. Cat scratch disease with encephalopathy in a 9-year-old girl. Pediatr Int 2008; 50(6): 823–824. doi: 10.1111/ j.1442-200X.2008.02747.x.
3. Choi AH, Bolaris M, Nguyen DK et al. Clinicocytopathologic correlation in an atypical presentation of lymphadenpathy with review of literature. Am J Clin Pathol 2015; 143(5): 749–754. doi: 10.1309/ AJCPPSKWRX0GD8HJ.
4. Blechová Z. Uzlinový syndrom. Postgraduální medicína 2006; 8(3): 332–338.
5. Freeman AM, Matt o P. Adenopathy. StatPearls [Internet] 2019. [online]. Available from: htt ps:/ / www.ncbi.nlm.nih. gov/ books/ NBK513250/ .
6. Pennisi MG, Marsilio F, Hartmann K et al. Bartonella species infection in cats. ABCD guidelines on prevention and management. J Feline Med Surg 2013; 15(7): 563–569. doi: 10.1177/ 1098612X13489214.
7. Fleischman DA, Chomel BB, Burgos BB. Impact of queen infetion on kott en susceptibility to diff erent strains of Bartonella henselae. Vet Microbio l 2015; 180(3–4): 268–272. doi: 10.1016/ j. vetmic.2015.09.020.
8. Bergmann M, Englert T, Stuetzer B. Prevalence of Bartonella species infections in cats in Southern Germany. Vet Rec 2017; 180(13): 325. doi: 10.1136/ vr.103843.
9. Day MJ. Pet-related infections. Am Fam Physician 2016; 94(10): 794–802.
10. Mathews DM, Vance DM, McMahon PM et al. An atypical case of Bartonella henselae osteomyelitis and hepatic disease. Case Rep Pediatr 2018; 2018: 2750275.
11. Hercík K, Hásová V, Janecek V et al. Molecular evidence of Bartonella DNA in ixodid ticks in Czechia. Folia Microbio l (Praha) 2007; 52(5): 503–509. doi: 10.1007/ bf02932111.
12. Burzo ML, Antonelli M, Pecorini G et al. Fever of unkown origin and splenomegaly: a case report of blood culture negative endocarditis. Medicine (Baltimore) 2017; 96(50): e9197. doi: 10.1097/ MD.0000000000009197.
13. Nakasu A, Ishimine T, Yasumoto H et al. Infective endokarditis associated with Bartonella henselae: a case series. IDCases 2018: 12: 127–129. doi: 10.1016/ j.idcr.2018.04.011.
14. Hozáková L, Rožnovský L, Rožnovský L. Uzlinový syndrom u nemoci z kočičího škrábnutí dětí a dospělých. Čas Lék čes 2018; 157: 146–151.
15. Lindeboom JA. Pediatric cervicofacial lymphadenitis caused by Bartonella henselae. Oral Surg Oral Med Oral Patho Oral Radiol 2015; 120(4): 469–473. doi: 10.1016/ j.oooo.2015.06.031.
16. Mazur-Melewska K, Mania A, Komnitz P et al. Cat-scratch disease: a wide spectrum of clinical pictures. Postepy Dermatol Alergol 2015; 32(3): 216–220. doi: 10.5114/ pdia.2014.44014.
17. Baranowski K, Huang B. Cat scratch disease. StatPearls [Internet] 2019. [online]. Available from: htt ps:/ / www.ncbi.nlm.nih. gov/ books/ NBK482139/ .
18. Balakrishnan N, Ericson M, Maggi E et al. Vasculitis, cerebral infarction and persistent Bartonella henselae infection in a child. Parasit Vector 2016; 9(1): 254. doi: 10.1186/ s13071-016-1547-9.
19. Zarraga M, Rosen L, Herschthal D. Bacillary angiomatosis in an immunocompetent child. A case report and review of the literature. AM J Dermatopathol 2011; 33(5): 513–515. doi: 10.1097/ DAD.0b013e3181ec846a.
20. Canneti B, Cabo-López I, Puy-Núňez A et al. Neurological presentations of Bartonella henselae infection. Neurol Sci 2019; 40(2): 261–268. doi: 10.1007/ s10072-018-3618-5.
21. Rafee Y, English BK. Skull osteomyelitis as a rare complication of cat scratch disease. Avicenna J Med 2018; 8(4): 157–159. doi: 10.4103/ ajm.AJM_81_18.
22. Sendi P, Hirzel C, Bloch A. Bartonella-associated transverse myelitis. Emerg Infect Dis 2017; 23(4): 712–713. doi: 10.3201/ eid2304.161733.
23. Mazzitelli M, Lamberti AG, Quirino A et al. Utility of molecular identifi cation and quantiation of Bartonella species with species-specifi c real-time PCR for monitoring treatment response: a case series. Open Microbio l J 2018; 12: 148–153. doi: 10.2174/ 1874285801812010148.
24. Shorbatli LA, Koranyi KI, Nahata MC. Eff ectiveness of antibiotic therapy in pediatric patients with cat scratch disease. Int J Clin Pharm 2018; 40(6): 1458–1461. doi: 10.1007/ s11096-018-0746-1.
25. King KY, Hicks MJ, Mazziott i MV et al. Persistent cat scratch disease requiring surgical excision in a patient with MPGN. Pediatrics 2015; 135(6): e1514–e1517. doi: 10.1542/ peds.2014-2923.
26. Mathews DM, Vance KM, McMahon PM et al. An atypical case of Bartonella henselae osteomyelitis and hepatis disease. Case Rep Pediatr 2018; 2018: 2018: 2750275. 10.1155/ 2018/ 2750275.
27. Saxena S, Kumar S, Kharbanda J. Toxoplasmosis submandibular lymphadenitis: report of an unusual case with a brief review. J Oral Maxillofac Pathol 2018; 22(1): 116–120. doi: 10.4103/ jomfp. JOMFP_268_17.
28. Čepička I, Lukeš J, Vávra J. Kmen Apicomplexa. In: Volf P. Paraziti a jejich bio logie. Praha: Triton 2007: 90–93.
29. Jíra J. Toxoplasma gondii a toxoplazmóza (toxoplasmosis). In: Jíra J. Lékařská protozoologie. 1. vyd. Praha: Galén 2009: 254–289.
30. Liu Q, Wang ZD, Huang SY et al. Dia gnosis of toxoplasmosis and typing of Toxoplasma gondii. Parasit Vectors 2015; 8: 292. doi: 10.1186/ s13071-015-0902-6.
31. Kodym P. Toxoplasma Centennial Congress (Toxo100) „From Discovery to Public Health Management“. Búzios, Rio de Janeiro, Brazílie, 20.–24. září 2008. [online]. Dostupné z: htt p:/ / www. parazitologie.cz/ zpravy/ doc/ Petr%20Kodym_Toxoplasma%20 Centennial%20Congress.pdf.
32. Dong H, Su R, Lu Y et al. Prevalence, risk factors, and genotypes of Toxoplasma gondii in food animals and humans (2000–2017) from China. Front Microbio l 2018; 9: 2108. doi: 10.3389/ fmicb.2018.02108.
33. Prášil P. Současné možnosti dia gnostiky a terapie toxoplazmózy u HIV negativních pacientů. Klin Mikrobio l Infekc Lek 2009; 15(3): 83–90.
34. Stejskal F. Toxoplasmóza. In: Beneš J. Infekční lékařství. Praha: Galén 2009: 332–335.
35. Geleneky M, Prášil P, Kodym P. Doporučený postup pro diagnostiku a léčbu toxoplazmózy. Klin Mikrobio l Infekc Lek 2017; 23(3): 102–120.
36. Cermáková Z, Prásil P, Valenta T et al. Zamyšlení nad „postavením“ metody PCR v rutinní dia gnostice toxoplazmózy při vyšetření priferní krve u imunokompetentních nemocných. Klin Mikrobio l Infekc Lek 2009; 15(4): 138–142.
37. Lukásová E, Cermák P, Smělá G et al. Tularémie – přehled současných poznatků. Klin Mikrobio l Infekc Lek 2010; 16(1): 22–27.
38. Maurin M, Gyuranecz M. Tularaemia: clinical aspects in Europe. Lancet Infect Dis 2016; 16(1): 113–124. doi: 10.1016/ S1473- 3099(15)00355-2.
39. Hestvik G, Warns-Petit E, Smith LS et al. The status of tularemia in Europe in a one-health context: a review. Epidemiol Infect 2015; 143(10): 2137–2160. doi: 10.1017/ S0950268814002398.
40. Černý Z. Tularémie. In: Beneš J. Infekční lékařství. Praha: Galén 2009: 256–259.
41. Cross AR, Baldwin VM, Sumita R et al. Zoonoses under our noses. Microbes Infect 2019; 21(1): 10–19. doi: 10.1016/ j.micinf.2018.06.001.
MUDr. Lubomíra Hozáková, Ph.D.
Klinika infekčního lékařství
Fakultní nemocnice Ostrava
Třída 17. listopadu 1790
708 52 Ostrava

