Tkanivové kultúry používané pre výrobu súčasných vakcín
V. Oleár (1,2), Z. Krištúfková (1), M. Štefkovičová (2)
(1) Fakulta verejného zdravotníctva, Slovenská zdravotnícka univerzita v Bratislave
(2) Fakulta zdravotníctva, Trenčianska univerzita Alexandra Dubčeka v Trenčíne
Súhrn
O niektorých kultivačných médiach používaných pri výrobe klasických vírusových vakcín sa najmä z religióznych dôvodov vedú spory o etických aspektoch pri ich použití. Pri kultivácii výlučne humánnych typov vírusov pre ich pomnoženie a rast možno v súčasnosti použiť takmer výhradne ľudské bunky – tkanivové a bunkové kultúry, bunkové línie. Tkanivové kultúry, ktoré sa používajú pri výrobe vakcín ako základné pomnožovacie média pre niektoré vírusy, sú významné možnosťou opakovaného použitia (na rozdiel od kuracích embryí a pod.) Pre účely vývoja a výroby vírusových vakcín sa tam, kde je to možné, využívajú i animálne tkanivové a bunkové kultúry, napr. VERO bunky alebo psie obličkové bunky. Iné tkanivové kultúry sú pripravené na báze humánnych buniek pôvodne získaných zo spontánne alebo umelo potratených embryí. Ľudské bunkové kultúry v žiadnom prípade nie je možné chápať ako kultúry, ktoré by sa obnovovali, napr. z nových buniek získaných z fetálnych orgánov pri spontánnych alebo umelých potratoch. Bunkové kultúry sa samostatne reprodukujú a ich DNA sa nedá použiť pre klonovanie. Je potrebné zdôrazniť, že žiaden potrat nebol vykonaný za účelom vývoja vakcíny.
Kľučové slová
tkanivová kultúra – bunková línia – vakcína
Bunkové kultúry sa často pomnožujú na médiach s obsahom kolagénu. Primárne bunkové kultúry sú tvorené z buniek odobratých priamo zo živého tkanivá a môžu obsahovať rôzne typy buniek, ako sú fi broblasty, epiteliálne a endotelové bunky. Pre potreby produkcie vakcín a pre potreby výskumu sú bunkové kultúry navrhnuté tak, aby obsahovali len jeden konkrétny kmeň buniek. Z pôvodnej kultúry buniek sa selektuje subkultúra, ktorá obsahuje len potrebný kmeň. Pre selekciu sa využíva viacero postupov – napr. centrifugácia, kedy sa oddeľujú veľké bunky od malých. Čisté bunkové línie umožňujú priebežnu kontrolu, ktorá pri zmiešaných tkanivových kultúrach obsahujúcich viac typov buniek nie je jednoduchá.
Pre životnosť bunkovej línie, schopnosť buniek sa rozmnožovať platí vo väčšine prípadov tzv. Hayflickov limit, pomenovaný po Leonardovi Hayflickovi. Ten zistil, že populácia normálnych buniek sa rozmnožuje len do určitej generácie (50- krát pri zdravých bunkách) a potom bunky odumierajú. Neplatí to však pre všetky bunky a ich línie, niektoré bunkové línie môžu byť imortalizované. To znamená, že bunky boli mutované tak, aby bola umožnená ich reprodukcia po neobmedzenú dobu. Jedným z príkladov sú tzv. HeLa bunkové línie, odvodené z transformovaných buniek odobratých v r. 1959 z krčka maternice ženy menom Henrietta Lantz (HeLa). HeLa bunka, tiež Hela, je typ bunky v nesmrteľnej bunkovej línii používanej vo vedeckom výskume. Je to najstaršia a najčastejšie používaná ľudská línia buniek odobratých dňa 8. februára 1951. U tejto bunkovej línie bolo zistené, že je pozoruhodne odolná a plodná (delenie buniek). Objavením bunkových kmeňov a bunkových línií bolo možné vyvinúť metódy pre rast a pomnožovanie vírusov v podmienkach in vitro a súčasne ich atenuovať. Je to základná podmienka pre výrobu živých vakcín, kedy sa atenuáciou vírusu dosahujú vlastnosti vakcinálneho vírusu, ktorý nie je schopný sa dobre alebo len minimálne pomnožovať v ľudskom organizme. Jedným z postupov pre atenuáciu vírusu pre vakcínu je napr. pasážovanie (opakované kultivácie) vírusu na bunkových kultúrach pri oveľa nižšej teplote, než je normálna telesná teplota. Vírus sa prispôsobí prostrediu, aby mohol replikovať pri nižších teplotách, a tým stráca svoju pôvodnú schopnosť rastu pri normálnej telesnej (ľudskej) teplote. Takto pripravený vakcinálny kmeň (za presne stanovených podmienok, napr. zloženie kultivačného media, rastová teplota a pod.) stráca svoju infekciozitu (nie na 100 %), ale pritom si zachováva svoje imunogénne vlastnosti [1].
Linie humánnych bunkových kultúr
Ľudské diploidné bunky
WI- 38 (Wistar – 38) – human diploid lung fi broblasts – ľudské fetálne diploidné bunky boli pripravené v r. 1961 v USA (Leonard Hayflick, Paul Moorhead) na Wistar Institute Philadelphia z pľúcnych buniek získaných z plodu dievčenského pohlavia umelo potrateného v 3. mesiaci tehotenstva zo zdravotných dôvodov vo Švédsku a nazvali ich WI-38. Normálne ľudské bunky sa v bunkových kultúrach delia zvyčajne 50-krát a následne umierajú. Hayflick sa pokúsil vytvoriť bunkovú líniu, ktorá by umožňovala mnohonásobné delenie a súčasne by bola bezpečná a vhodná ako kultivačné médium. Jeho 38. pokus s líniou buniek (pľucnych fibroblastov získaných z umelo potrateného plodu) sa podaril a získal líniu buniek, ktoré nevykazovali ani pri opakovaných
deleniach žiadne abnormality, a ich rast pokračoval normálne bez závislosti na počte delení (neobmedzené – nesmrtelné delenie buniek). WI- 38 bunkové línie sa používajú napr. pri výrobe vakcíny proti rubeole. Vakcinálny kmeň pre vakcínu proti rubeole je známy ako RA 27/3 a bol získaný od plodu z terapeuticky indikovaného potratu (matka mala rubeolu počas tehotenstva). RA 27/3 je teda kmeň vírusu rubeoly, ktorý sa používa pre vakcíny, a nie je to tkanivo z potrateného plodu, ako sa niekedy uvádza na stránkach internetu. Vírusy sa replikujú v bunkových kultúrach WI- 38, extrahujú sa z diploidných bunkových kultúr a následne sú ďalej spracované tak, aby sa pripravil vlastný substrát pre vakcínu. Bunková línia WI- 38 (human lung fi broblast, normal) – kultivačné médium pozostáva zo základného média EMEM (Eagle‘s minimum essential medium) s 2 mM L- glutaminu, 1,5 g/l bikarbonátu sódneho, 0,1 mM neesenciálnych aminokyselín, 1,0 mM pyruvátu sódneho a 10% FBS (fetal bovine serum) [2].
WI-26 VA4
Línia buniek WI-26 VA4 (Wistar institute) je derivátom línie ľudských diploidných fibroblastov z embryonálnych pľúcnych buniek získaných od plodu kaukazského typu (beloch) mužského pohlavia potrateného v 3. mesiaci tehotenstva. Je to línia buniek získaných od toho istého plodu ako línia WI-38, ale z 26. delenia v rade a následnej transformácie vírusu SV 40 (siminian vírus). Bunky sú pozitívne na SV40 a neo (T) antigén. Bunky obsahujú antigén vírusu SV40 T- Ag, ktorý sa nemôže retransformovať na aktívnu formu vírusu [1].
MRC- 5
V septembri r. 1966 vo Veľkej Británii získali vedci (J. P. Jacobs) z Medical Research Council pľúcne bunky od 14-týždňov starého, umelo potrateného mŕtveho chlapčenského plodu (z psychiatrickych dôvodov od 27-ročnej fyzicky zdravej ženy). Tkanivová kultúra, ktorá takto vznikla, bola nazvaná MRC-5 (Medical Research Council 5). Obidve tkanivové kultúry majú rovnaký počet chromozómov ako normálne ľudské bunky a dlhodobo si zachovávajú pôvodné vlastnosti – bunky sú schopné 42–46 delení pred ich umrtím (apoptózou) [3]. MRC-5 bunková línia je bežne využívaná vo vývoji vakcín. MRC-5 bunky, ktoré rastú adherentne v kultúre fi broblastov môžu zdvojnásobiť početnosť populácie 42–46-krát. Sú vhodné pre kultiváciu poliovírusov 1, herpes simplex a vírusu vezikulárnej stomatitídy (Indiana kmeň) [4]. Kultivačné médium: Hamove F12 medium (1 : 1 mix), obohatené s 2 mM L-glutaminu a 5 % fetálneho hovädzieho séra [5].
IMR- 90
Nová humánna línia diploidných buniek IMR-90 bola vytvorená pre výskum a technologické účely. Národný inštitút pre starnutie (National Institute of Aging – NIA), National Institutes of Health (NIH), na základe zmluvy s Institute for Medical Research (IMR) v Camden, New Jersey (Inštitút pre lekársky výskum), začali vyvíjať líniu IMR-90 ako náhradu pre líniu buniek WI-38. Kultúra bola odobratá od 16-týždňov (dĺžka 7 cm) starého ľudského plodu ženského pohlavia získaného 7. 7. 1975 od terapeutického potratu u 38-ročnej ženy kaukazského typu (belošky). Ako kultivačné médium pre líniu buniek IMR- 90 sa používa EMEM 500 ml + 2 mM Glutaminu + 10 % fetálneho hovädzieho séra. Pasážovanie je možné 16-krát [6].
PER.C6
Bunková línia bola prvá línia pripravená na základe požiadavku spoločnosti Eye Integrated Pharma (Greenville). Názov vznikol zo slova „Percivia“, ktorý spája názov prvej fázy technológie (PERC) a slova „VIA“, ktoré sa skladá z latinskej VI = 6 a súčasne symbolicky „VIA“ znamená i cestu alebo život. Bunková línia z retinálneho tkaniva odobratého doktorom Van Der Eb (Leiden University) od plodu potrateného v 18. týždni gestácie. V r. 1985 sa pripravil do podoby bunkovej línie, ktorá sa používa až od r. 1995. Potrat bol umelý na základe požiadavky matky (sociálna), inakšie normálneho tehotenstva.
PER.C6 je bunková línia odvodená od ľudských embryonálnych buniek sietnice transformovaných s adenovírusom typu 5 (AD5) E1A a E1b génov. Línia PER.C6 sa niekedy porovnáva s líniou HEK 293 (ľudské embryonálne obličkové bunky, human embryonic kidney cells – HEK), ale dôvody pre ich prípravu boli rozdielne. Cieľom pre prípravu HEK 293 bol pôvodne základný výskum, línia PER.C6 bola pripravená cielene pre výrobu vakcín na základe objednávky [7]. Je to rastové médium vhodné pre široké spektrum ľudských vírusov spôsobujúcich ochorenia a slúži pre výrobu inaktivovaných celovírusových, živých oslabených, živých vektorových, splitových, subjednotkových, resp. rekombinantných vakcín. Je vhodná pre kultiváciu vírusov
k výrobe vakcín proti vírusom ako napr. Ebola, West Nile horúčke, chrípke, malárii, TBC [8].
HEK 293 bunky
HEK 293 bunky boli získané transformáciou ľudských embryonálnych obličkových buniek s upravenou DNA adenovírusom 5 v Alex Van der Ebovom laboratóriu v holandskom Leidene a prvý raz boli popísané v r. 1977 [9]. HEK bunky boli získané z embryonálnych obličkových buniek od zdravého spontánne potrateného plodu v r. 1972. Frank Graham vykonal transformáciu s adenovírusovou DNA, pričom úspešný bol až 293. pokus, čo je obsiahnute i v názve bunkovej kultúry HEK 293. Táto bunková línia je v súčasnosti jednou z najpoužívanejších pri výrobe vírusových vakcín. Využitie ľudských diploidnych buniek (human diploid cells – HDC) pre výrobu vírusových vakcín umožnilo vyvinúť vakcíny proti rubeole, hepatitíde A, varicelle a nových vakcín proti besnote. Dve základné bunkové kultúry (WI-38 a MRC-5) sa udržujú v laboratórnych podmienkach už viac ako 50 rokov.
Namalwa
Línia ľudských B lymfocytov získaných primárne od afrického detského pacienta v r. 1967. Využíva sa najmä pri výrobe interferónu. Bunky rastú u nahých (imunodeficientných) myší [10]. Bunky vylučujú nízke množstvo monoklonálnych protilátok (IgM, ľahkého reťazca lambda) neznámej špecifickosti. Namalwa bunky boli použité ako zdroj lymfoblastoidných interferónov a sú používané ako alternatíva iných mamaliálnych (cicavčích) tkanivových systémov. Namalwa bunky môžu byť pestované v chemicky definovanom médiu bez séra vo veľkom množstve, ktoré umožňuje masovú priemyselnú výrobu [11].
Linie nehumánnych bunkových kultúr
Typické a najviac používané nehumánne tkanivové bunkové kultúry pri výrobe vakcín sú primárne kuracie embryonálne fibroblasty (chicken embryo fibroblasts – CEFs) [12]. Tieto bunkové substráty však majú v porovnaní s „klasickými“ tkanivovými kultúrami viacero obmedzení, vrátane rizika nedostatočného zásobovania, časovo náročné procesy s nerovnakými rastovými podmienkami a následne výnosom kultúry, vysoké náklady na výrobu, potenciálu pre alergické reakcie na vaječné komponenty. Existujú dve hlavné kategórie vajec pre výrobu vakcín: CE (clean eggs) a SPFE (specifi ed pathogen free eggs) [13].
.bmp)

Clean eggs (čisté vajcia)
Tieto vajíčka sú produkované z chovov podobných rodičovských kŕdľov, kde je predpoklad rovnakej kvality vajec. Hlavné kritériá pre tieto vajcia je čistota a plodnosť rodičovskej populácie. Najväčší objem týchto vajec sa používa pre výrobu vakcín proti ľudskej chrípke. Medzi hlavné dôvody pre používanie clean vajec k výrobe vakcíny proti ľudskej chrípke patrí potreba obrovského množstva sezónnych vajec a vyššie náklady na výrobu SPF vajec. Na výrobu potrebného množstva jedného antigénu pre jednu dávku vakcíny potrebujeme zvyčajne jedno vajíčko, to znamená pre jednu dávku trivalentnej vakcíny proti chrípke potrebujeme tri vajcia. Ak by sme chceli použiť len vajcia SPFs, produkcia vakcín proti chrípke by bola nedostatočná. Objem trhu pre CE vajcia pre výrobu vakcín proti chrípke sa odhaduje na 530 miliónov vajec ročne.
Specified pathogen free eggs (vajcia bez špecifi ckých patogénov)
Vajcia bez špecifických patogénov sú vyrábané za prísnych podmienok v izolovaných chovoch tak, aby bola zaručená neprítomnosť všetkých agensov ochorení a protilátok proti mikroorganizmom, ktoré sú stanovené v Európskom liekopise. SPF vajcia sa používajú najmä pre výrobu živých vakcín. Celková kapacita SPF vajec sa odhaduje na celom svete 60– 65 milionov kusov, pričom sú len traja producenti týchto vajec [14]. Humánne vírusy kultivovateľné na kuracích embryách: Infl uenza virus, Measles virus (morbilli), Rabies virus (besnota), Rubella virus (rubeola), Mumps virus (parotitída), Smallpox virus (Variola), Tick-borne encephalitis virus (kliešťová encefalitída), Yellow fever virus (žltá zimnica), Venezuelan EEV virus (Venezuelská koňská
encefalitída).
VERO bunky
Sú bunky izolované z epitelilálnych buniek obličiek získaných od africkej zelenej opice Cercopithecus aethiops [15]. Verda reno (VERO) bunky sú línie buniek v bunkových kultúrach vyvinuté 27. marca 1962 Yasumurom a Kawakitomom na Chiba Universite v Chiba, v Japonsku. Originálna línia bola nazvaná v jazyku esperanto podľa verda reno, čo znamená zelené obličky. VERO bunky sa používajú ako východisko pre výrobu IPV vakcín, rabickej vakcíny a pod [16].
CHO(C)
CHO(C) sú bunkové línie odvodené z vaječníka čínskeho škrečka a často sa používajú v biologickom a lekárskom výskume pri výrobe terapeutických proteínov. Prvé bunkové kultúry CHO (bunky z vaječníkov čínskeho škrečka, Chinese hamster ovary cells – CHO(C)) boli pripravené v r. 1960 [17]. CHO bunky sa používajú pri štúdiu genetiky, screening toxicity, výživy a génovej expresie, a to najmä pre expresiu rekombinantných proteínov. V r. 1957 Theodore T. Puck získal samičku čínskeho škrečka od dr. George Yerganiana (laboratórium Boston Cancer Research Foundation) [18]. CHO bunky sa stali bunkovou líniou voľby vďaka rýchlemu rastu a produkcii s vysokým obsahom bielkovín. Prvá CHO bunková línia bola odvodená z pôvodných bunkových línií v laboratóriu dr. Van Pucka pomocou klonovania jedinej bunky v r. 1957. CHO kultúry sa používajú pri výrobe rekombinantných vakcín proti VHB a vakcín proti chrípke. Potenciál CHO kultúr je však ešte oveľa väčší. Napríklad vakcíny proti VHB pripravené na CHO bunkách obsahujú všetky tri povrchové proteiny (antigény) S, Pre-S1, Pre-S3.
MDCK bunky
Pre výrobu vakcín sa javí ako perspektívna línia buniek Madin darby canine kidney – MDCK línia, ktorá bola izolovaná v septembri r. 1958 obličkových buniek zo samičky kokršpaniela. Niektoré európske vakcíny sú už vyrobené s použitím MDCK, napr. niektoré vakcíny proti chrípke. Morfológia bunkovej línie MDCK je epiteliálna. MDCK bunky sú vhodné pre kultiváciu vírusov ako napr. vezikulárna stomatitída (Indiana kmeň), vakcinia, coxsackievirus B3, B4, B5, reovirus 2 a 3, adenovírus 4 a 5, poliovírus 2 [19,20].
NS0 and SP2/ 0
NS0 and SP2/ 0 (mouse-myeloma from B lymphocytes) sa používajú pre výrobu monoklonálnych protilátok. Bunkové línie myšacích lymfatických buniek NS0 a SP2/ 0-AG14 boli získané v r. 1975 z buniek myší. Bunkové línie boli opakovane klonované a pri línii buniek SP2/ 0 boli spojené s bunkami sleziny z inej myšiej línie [21]. Tieto línie buniek sa využívajú pri hybridomových technológiach – vytváranie hybridných bunkových línií (hybridomasy) tým, že ničí špecifickú protilátku produkovanú B bunkami s myelómom. Protilátky produkované hybridómom sú monoklonálne. Za tento objav dostali César Milstein a Georges JF Köhler v r. 1975 Nobelovu cenu a v r. 1984 Niels Kaj Jerne. Termín hybridomy zaviedol v r. 1976 Leonard Herzenberg. B bunky, ktoré produkujú požadované protilátky, môžu byť opakovane klonované v dcérskych líniach [22].
Záver
Kontrolu nad všetkými používanými líniami buniek, a to pre prax i pre experimentálne využitie, vykonáva Svetová zdravotnícka organizácia (WHO) [23]. WHO RCBs (Reference cell banks) bola založená v r. 1987, aby sa testovala vhodnosť bunkových línií pre ich použitie pri výrobe vakcín. RCB WHO poskytuje jedinečný zdroj pre rozvoj budúcich biologických liečiv, kde sa požaduje bunkový substrát s bezpečnou a spoľahlivou históriou používania. RCB je považovaná i za banku pre generovanie buniek materských línií. Každá bunková línia, ktorá by sa javila ako vhodná pre technologické alebo výskumné využitie, musí byť schválená RCB. Používanie bunkových línií, humánnych i nehumánnych, pre výrobu vakcín bez schválenia RCB nie je možné.
Literatúra
1. History of Vaccines by Wistar Institute President. Available from: http:/ /www.historyofvaccines.org/ content/ blog/ history- vaccines- wistar-institute- president.
2. WI38 (Human lung fi broblast cell line) Whole Cell Lysate (ab3960). Abcam. Available from: http:/ /www.abcam.com/ wi38- human- lung- fi broblast- cell-line-whole- cell- lysateab3960.htm.
3. MRC-5 ATCC® CCL- 171™ Homo sapiens lung Normal. Available from: http:/ /www.lgcstandards-atcc.org/ Products/ All/ CCL-171.aspx.
4. Human Fetal Lung Fibroblast Cells (MRC- 5 Line). Available from: http:/ /micro.magnet.fsu.edu/ primer/ techniques/ fl uorescence/ gallery/ cells/ mrc5/ mrc5cells.html.
5. MRC-5. CLS Cells Line Service. Available from: http:/ /www.cell-lines- service.de/ content/e3969/ e4567/ e4610/ index_eng.html.
6. IMR- 90 (ATCC® CCL- 186™). ATCC. Homo sapiens lung normal. Available from: http:/ /www.atcc.org/ products/ all/ CCL- 186.aspx#generalinformation).
7. Vaccines and related bio logical products advisory committee meeting wednesday, 2001. U.S. Food and Drug Administration. Available from: http:/ /www.fda.gov/ ohrms/ dockets/ac/ 01/ transcripts/ 3750t1_01.pdf.
8. To Produce New Flu Vaccine Using Cancer– Potential Aborted Fetal Cell Line PER C6. Med- Immune Inc. Available from: http:/ /www.cogforlife.org/ fluPress.htm.9. Graham FL, Smiley J, Russell WC et al. Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J Gen Virol 1977; 36(1): 59– 74.
10. Namalwa. COPE – Cells, Cell Communication, Cancer Cells, Cytokines. Online Pathfinder Encyclopedia. Available from: http:/ /www.copewithcytokines.de/ cope.cgi?key=Namalwa.
11. Henault M, Lee LN, Evans GF et al. The human Burkitt lymphoma cell line Namalwa represents a homogenous cell system characterized by high levels of Toll-like receptor 9 and activation by CpG oligonucleotides. J Immunol Methods 2005; 300(1–2): 93– 99.
12. Ben-Nathan D. Production of poultry viral vaccines in embryonated eggs. Adv Biotechnol Processes 1985; 5: 123– 147.
13. Kock M, Seemann G. Fertile eggs – a valuable product for vaccine production. Lohman Information 2008; 43(2): 37.
14. Specific Pathogen Free (SPF) embryonated chicken eggs. Federal Bussines Opportunities. Available from: https:/ /www.fbo.gov/ index?s=opportunity&mode=form&id=e5bed-42ff 2b3312aa737faba5ff 1b49e&tab=core&_cview=0.
15. Sheets R. History and Characterization of the Vero Cell Line. Available from: http:/ /www.fda.gov/ohrms/dockets/ac/00/backgrd/3616b1a.pdf.
16. Nor YA, Sulong NH, Maizirwan M et al. The Growth Study of Vero Cells in Different Type of Microcarrier. Materials Sciences and Applications 2010; 1: 261–266. Available from: http:/ /www.scirp.org/ journal/PaperInformation.aspx?PaperID=3286.doi: 10.4236/ msa.2010.15038.
17. Omasa T, Onitsuka M, Kim WD. Cell engineering and cultivation of chinese hamster ovary (CHO) cells. Curr Pharm Biotechnol 2010; 11(3): 233– 240.
18. Kao FT, Puck TT. Genetics of somatic mamalian cells IV. Properties of Chineses hamster cell mutants with respect to the requirement for proline. Genetics 1967; 55(3): 513– 524.
19. MDCK (NBL- 2) (ATCC® CCL-34™). ATCC. Available from: http:/ /www.atcc.org/ products/all/ CCL- 34.aspx#generalinformation.
20. Human vaccines produced with animal cell technology. Available from: http:/ /www.actip.org/ pages/ vaccinestable.html.
21. Baltz RH, Demain AL, Davies JE et al. Manual of Industrial Microbio logy and Biotechnology. Engelska: American Society for Microbio logy 2010.
22. Shabani M, Hemmati S, Hadavi R et al. Optimization of gene transfection in murine myeloma cell lines using diff erent transfection reagents. Avicenna J Med Biotechnol 2010;2(3): 123– 130.
23. WHO Reference Cell Banks (RCBs). Available from: http:/ /www.who.int/biologicals/areas/vaccines/WHO_reference_cell_banks/en.
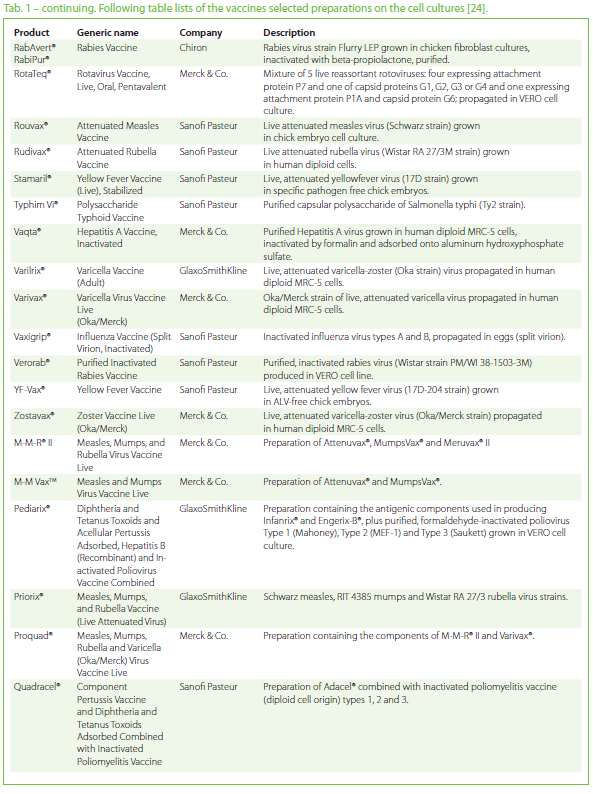
24. Vaccines. U.S.A table lists selected preparations for use in the prevention of infectious diseases by immunization. Whitehouse Station: Merck Sharp & Dohme Corp 2006. Available from: http:/ /issuu.com/ thelifesciencenews/ docs/ vaccines.
doc. MUDr. Vladimír Oleár, CSc.
Fakulta zdravotníctva
Trenčianska univerzita Alexandra Dubčeka v Trenčíne
Študentská 2, 911 50 Trenčín
www.tnuni.sk
Zpět na seznam článků

