Tafenoquin – nový preparát v prevenci malárie
J. Dvořák
Centrum Očkování a cestovní medicíny Avenier, Praha 6
Souhrn
Malárie je závažné, život ohrožující onemocnění přenášené krev sajícími moskyty rodu Anopheles. Etiologickým agens jsou prvoci rodu Plasmodium (Pl). Nákaze lze předcházet chemoprofylaxí a existuje na ni kauzální terapie. Nicméně dostupné preparáty preventivně cílí především na Pl. falciparum. V posledních letech se mění náhled na Pl. vivax jako na benigní formu malárie a vznikla poptávka po novém účin ném preparátu k profylaxi i léčbě. V roce 2018 byl v USA a v Austrálii registrován nový 8-aminochinolin tafenoquin.
Klíčová slova
malárie – Plasmodium vivax – chemoprofylaxe – tafenoquin
Etiologie malárie
Infekčním původcem malárie je jednobuněčný parazit rodu Plasmodium (Pl). Existuje celkem 5 druhů, které způsobují onemocnění u člověka: Pl. falciparum, Pl. vivax, Pl. ovale, Pl. malariae a Pl. knowlesi. Infekce je přenášena samičkami komárů rodu Anopheles při sání krve, které ve svých slin ných žlázách obsahují infekční stadia – sporozoity. Při sání sporozoity vstupují do krevního oběhu a odtud pronikají do jater, kde infikují hepatocyty. V jaterních buňkách se jako jaterní schizonty jednorázově nepohlavně pomnoží. Tento jaterní cyklus je zcela asymp tomatický. Sporozoity Pl. vivax a Pl. ovale nemusí v hepatocytech zahájit dělení a transformují se ve spící stadia – hypnozoity. Hypnozoity se mohou aktivovat a zahájit dělení s odstupem několika měsíců a jsou zodpovědné za relapsy nebo za oddálený klinický nástup. Jaterní schizonty opouštějí hepatocyt jako merozoity a vzápětí napadají erytrocyty, v nichž se opakovaně nepohlavně množí jako krevní schizonty. Erytrocytární cykly se postupně sjednotí a podle druhu plazmodia trvají 24 (Pl. knowlesi), 48 (Pl. falciparum, Pl. vivax a ovale) nebo 72 hod (Pl. malariae). Po dostatečném namnožení merozoitů se napadený erytrocyt rozpadá a uvolněné merozoity napadají další červené krvinky. Tato fáze je již doprovázena typickými klinickými příznaky, tzv. malarickými záchvaty. Část merozoitů se v červených krvinkách transformuje na gametocyty (sexuální stadia plazmodií). Po jejich nasátí komárem pak pokračuje cyklus v hmyzím vektoru [1].
Epidemiologie malárie
Podle čerstvých epidemiologických dat v roce 2017 byla v riziku malárie téměř polovina celosvětové populace. V roce 2010 bylo hlášeno 239 milionů případů malárie, v roce 2017 to bylo 219 milionů. Se svými 200 miliony případů v roce 2017 zůstává Afrika nejpostiženějším regionem (92 % případů). Druhým nejvíce postiženým regionem je jihovýchodní Asie (5 % případů) a dále východní Středomoří (2 % případů). Od roku 2015 případů nijak významně neubývá, avšak mezi lety 2010 a 2017 se odhadovaná úmrtnost na malárii celosvětově snížila z 607 000 na 435 000 případů. Pl. falciparum je zodpovědné za asi 99,7 % případů v africkém regionu, za 69 % ve východním Středomoří, 62,8 % v jihovýchodní Asii a 71,9 % v západním Pacifi ku. Pl. vivax jako původce malárie převládá ve Střední a Jižní Americe (74,1 % případů), nezanedbatelná incidence je však i v jihovýchodní Asii a západním Pacifiku. Nicméně přibližně 82 % případů malárie způsobených Pl. vivax bylo v roce 2017 hlášeno pouze z 5 zemí: Indie, Pákistán, Etiopie, Afghánistán a Indonésie [2]. V Evropě byla malárie eradikována, vyskytují se pouze importované případy. V ČR je nahlášeno kolem 30 importovaných případů za rok, v roce 2018 to bylo 36 [3].
Klinický obraz, rizikové skupiny
Závažnost průběhu malárie souvisí především se stavem imunity člověka. V subsaharské Africe jsou komplikovaným průběhem ohroženy především děti do 3 let věku. V průběhu života v oblasti s celoročním vysokým výskytem se u hostitele vytváří částečná imunita (semiimunita), díky které riziko závažného průběhu klesá. S klesající četností výskytu se symptomatické průběhy posunují do vyššího věku a v oblastech s nízkou incidencí malárie je nemocnost přibližně stejná ve všech věkových kategoriích. Mezi rizikové skupiny tak patří malé děti, těhotné ženy, osoby s imunodeficitem, ale rovněž cestovatelé z neendemických zemí, kteří jsou imunologicky naivní [4]. Po prodělané infekci (i opakované) onemocnění nezanechává u cestovatele trvalou imunitu [1]. Inkubační doba u nákazy způsobené Pl. falciparum je nejméně 6 dní, asi u 90 % nakažených cestovatelů se však první příznaky rozvíjejí asi 8 týdnů po opuštění malarické oblasti. Hypnozoity Pl. vivax se mohou aktivovat v krajních případech až po 9– 12 měsících po nákaze. Symp tomy jsou nespecifické, připomínají vystupňované chřipkovité příznaky: bolesti hlavy, svalů a kloubů, vysoké horečky se zimnicemi a třesavkou, nechutenství, břišní diskomfort, apatie. Při přirozeném, léčbou nemodifikovaném průběhu se postupně synchronizují erytrocytární cykly parazita a podle jeho druhu se malarické záchvaty objevují v typických periodách: pro Pl. vivax a Pl. ovale je charakteristický 2den ní cyklus („terciána“, horečka se objevuje každý 3. den), u Pl. malariae se záchvaty vyskytují po 3 dnech („kvartána“, každý 4. den). Výskyt horeček u nákazy Pl. falciparum je obecně mnohem variabilnější, jelikož infekce bývá méně synchronizovaná [1,4]. Závažná forma malárie zpravidla postihuje imunologicky naivní nebo oslabené osoby. Nejčastěji je za maligní průběh zodpovědná nákaza Pl. falciparum, avšak průběh infekce Pl. vivax může být rovněž vážný, až život ohrožující. Mezi klinická kritéria závažné formy malárie patří porucha vědomí (mozková malárie), metabolická acidóza, selhání ledvin, ikterus. U pacientů s rozvinutým multiorgánovým selháním je vysoká letalita [1,4].
Plasmodium vivax jako příčina maligní malárie
Výskyt prvoka Pl. vivax jde, až na několik výjimek, ruku v ruce s výskytem Pl. falciparum. Dominuje především v zemích Střední a Jižní Ameriky, častý je také v jižní a jihovýchodní Asii, na Korejském poloostrově je incidence dokonce 100 %. Virulence se u jednotlivých kmenů Pl. vivax liší, podle recentních studií je však zřejmé, že málo virulentní kmeny byly časem vytlačeny kmeny virulentnějšími. Nemocní infikovaní Pl. vivax mají, podle některých metaanalýz, v podstatě srovnatelné riziko maligního průběhu s rozvojem těžké anémie a trombocytopenie, respirační insuficience, poruch jaterních a ledvinných funkcí, poruch vědomí a selhání oběhu [5,6]. Celkový pohled na malárii vyvolanou Pl. vivax jako na benigní a neškodnou infekci se v posledních letech mění pod tíhou důkazů, dle kterých infekce Pl. vivax představuje reálné riziko maligního průběhu. Dlouhodobé opomínání Pl. vivax mělo za následek nedostatek účinných preparátů k její prevenci a léčbě, na trhu byl v posledních více než 60 letech dostupný pouze primachin [6].
Principy antimalarické profylaxe
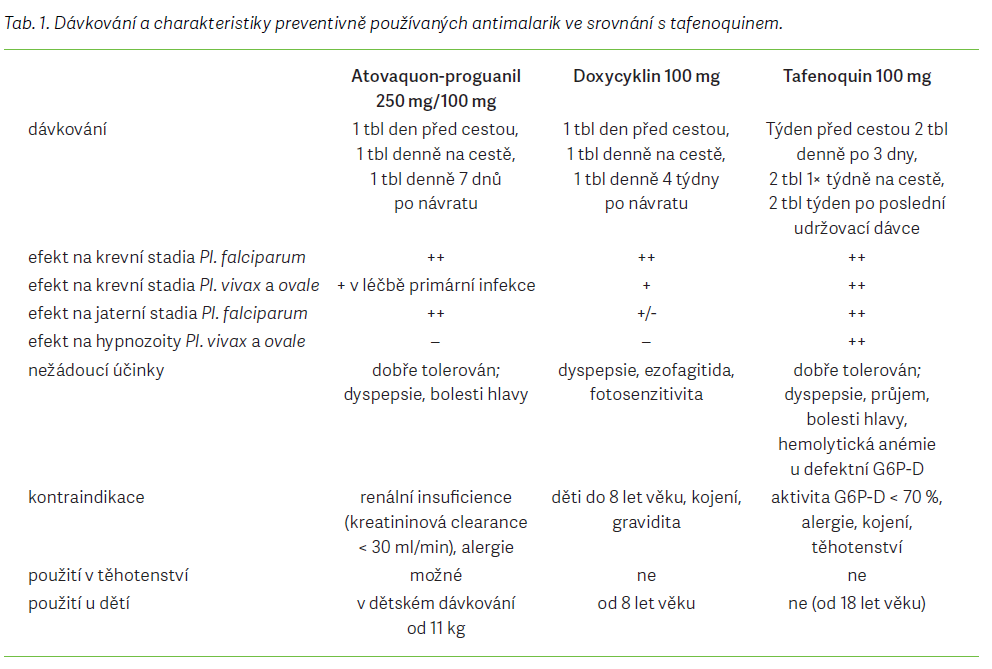
Preparáty užívané k chemoprofylaxi a léčbě malárie mají odlišná místa účinku. V profylaxi používaný chlorochin, doxycyklin a meflochin účinkují především na krevní stadia plazmodií (merozoity), atovaquonproguanil účinkuje na krevní stadia a na jaterní schizonty Pl. falciparum, ale nikoli na hypnozoity Pl. vivax či Pl. ovale. Proti dormantním jaterním stadiím Pl. vivax a Pl. ovale spolehlivě působil doposud pouze primachin. Je důležité si uvědomit, že chemoprofylaxe nezabrání infekci jako takové (jako například očkování), ale zamezuje klinickému onemocnění či snižuje jeho závažnost [7,8]. Podle principu a místa účinku rozdělujeme antimalarickou chemoprofylaxi na supresivní a kauzální. Supresivní profylaxe cílí na krevní stadia parazita, kdežto kauzální na jaterní. V supresivní profylaxi je nutné pokračovat 4 týdny po opuštění malarické oblasti, a to kvůli likvidaci parazitů případně uvolněných z jater s časovým odstupem od infekce. Výjimkou je atovaquon-proguanil (Malarone™), kdy vzhledem k jeho aktivitě proti jaterním stadiím lze v profylaxi pokračovat jen týden od expozice. Nicméně, jak bylo zdůrazněno, tento preparát ničí pouze jaterní schizonty Pl. falciparum. Doposud existující preparát účinkující na hypnozoity Pl. vivax a Pl. ovale primachin (Primaquine™) je teoreticky možné použít k chemoprofylaxi do oblastí s převažujícím výskytem Pl. vivax či Pl. ovale. Rovněž je užíván k takzvané terminální či presumptivní protirelapsové terapii, kdy se užívá v průběhu posledních 1–2 týdnů supresivní profylaxe jiným preparátem a 1 týden po expozici [7–9]. Před nasazením primachinu, z jakékoli indikace, se musí vyšetřit aktivita enzymu glukóza- 6-P-dehydrogenázy (G6P-D). Deficit G6P-D je jedna z nejčastějších genetických abnormalit u člověka. U osob s aktivitou G6P-D nižší než 70 % je riziko život ohrožující hemolytické anémie [8,9].
Tafenoquin jako profylaxe malárie u cestovatelů
Primachin se však k antimalarické profylaxi v široké praxi neujal, a to z několika důvodů: v řadě zemí, vč. ČR, není k chemoprofylaxi malárie registrován, dále vykazuje nízkou aktivitu vůči asexuálním krevním stadiím Pl. falciparum, a navíc ze všeobecně přijímaného názoru, že malárie způsobená Pl. vivax je neškodná. Z uvedených důvodů vyplynula dominance supresivní antimalarické profylaxe v běžné praxi. Pokud tedy hovoříme o antimalarické chemoprofylaxi, ve skutečnosti jde v podstatě o profylaxi tropické malárie způsobené Pl. falciparum [6,8]. V roce 2018 byl v USA a v Austrálii zaregistrován nový přípravek tafenoquin. Jde o 8-minochinolin (stejně jako primachin) a je registrován k chemoprofylaxi malárie a radikální léčbě infekce vyvolané Pl. vivax. Spektrum účinku v profylaxi zahrnuje jaterní schizonty a hypnozoity a krevní stadia všech druhů rodu Plasmodium. Účinná látka byla objevena americkou armádou v roce 1978, avšak až v posledním desetiletí začala být předmětem klinického výzkumu. K profylaxi malárie byla v USA zaregistrována pod obchodním názvem Arakoda™, v Austrálii pak pod názvem Kodatef™. Výrobcem je 60 Degrees Pharmaceuticals. GlaxoSmithKline ve spolupráci s Medicines for Malaria Venture zaregistroval ve stejných zemích tafenoquin k léčbě Pl. vivax a Pl. ovale – Krifantel™ v USA a Kozenis™ v Austrálii [8,10]. Arakoda™ i Kodatef™ jsou vyráběny ve formě tablet obsahujících 100mg účinné látky. Použití je možné u osob starších 18 let. Obdobně jako u primachinu je před nasazením nutné vyšetřit aktivitu G6P-D. Mezi kontraindikace tafenoquinu patří vedle defektu G6P-D také gravidita, kojení, anamnéza psychotických onemocnění, známé reakce z přecitlivělosti na tafenoquin či jiné 8-aminochinoliny. Chemoprofylaxe se zahajuje týden před vstupem do malarické oblasti úvodní dávkou 200mg tafenoquinu (dvě 100mg tablety) den ně po dobu 3 dní, 7 dní po poslední úvodní dávce následuje udržovací dávkování 200mg 1× týdně. Po opuštění malarické oblasti se užij í 2 tablety týden po poslední udržovací dávce. Maximální doba užívání je, vzhledem k nedostatku dlouhodobých dat, prozatím stanovena na 6 měsíců [10,11]. Nespornými výhodami nového preparátu je spektrum účinku zahrnující všechny druhy plazmodií a pohodlné týden ní dávkování při pobytu v malarické oblasti. Přípravek je dobře tolerován, nejčastějšími nežádoucími účinky bývají průjem, nevolnost, zvracení, bolesti zad a krku. Vzhledem k dlouhému biologickému poločasu léčiva se mohou nežádoucí účinky dostavit s delší latencí (i více než 14 dní po vysazení). Nevýhodou preparátu je nutné vyšetření aktivity G6P-D [10,11]. Charakteristiky tafenoquinu v porovnání s preparáty používanými v ČR k chemoprofylaxi malárie ilustruje tab. 1.
Literatura
1. Stejskal F, Nohýnková E, Kosina P et al. Dia gnostika, léčba a profylaxe malárie v České republice. Klin Mikrobiol Inf Lék 2018; 24(1): 20–0.
2. World Health Organization. World malaria report 2018. 2018. [online]. Available from: https://www.who.int/malaria/publications/world-malaria-report-2018/en/ .
3. Státní zdravotní ústav. Výskyt vybraných infekcí v České republice hlášených v letech 2009– 2018 a leden– srpen 2019. [online]. Dostupné z: http://www.szu.cz/search.php?action= results&query=v%C3%BDskyt+vybran%C3%BDch+ infekc%C3%AD+v+&x=0&y=0.
4. Cohen J, Powderly W, Opal S. Infectious Dis eases. 3rd ed. Mosby 2010: 1161.
5. Baird JK. Management of Plasmodium vivax risk and il lness in travelers. Trop Dis, Travel Med and Vacc 2017; 3: 7. [online]. Available from: https://tdtmvjournal.bio medcentral. com/articles/10.1186/ s40794-017-0049-x.
6. Baird JK. Suppres sive chemoprophylaxis invites avoidable risk of serious il lness caused by Plasmodium vivax malaria. Travel Med Infect Dis 2013; 11(1): 60– 65. doi: 10.1016/ j. tmaid.2013.01.002.
7. Schwartz E. Prophylaxis of malaria. Mediterr J Hematol Infect Dis 2012; 4(1): e2012045. doi: 10.4084/ MJHID.2012.45.
8. Baird JK. Tafenoquine for travelers’ malaria: evidence, rationale and recom mendations. J Travel Med 2018; 25(1). doi: 10.1093/jtm/tay110.
9. Tan KR, Arguin M. Malaria. Centers for Dis ease Control and Prevention. Traveler’s health. Travel-related infectious dis eases. 2019. [online]. Available from: https://wwwnc.cdc.gov/travel/yellowbook/2020/travel-related-infectious-diseases/malaria.
10. Freedman DO. Tafenoquine: integrat ing a new drug for malaria prophylaxis into travel medicine practice. J Travel Med 2019; 26(4). doi: 10.1093/jtm/tay140.
11. Highlights of prescrib ing information. Arakoda – summary of product characteristics. 2018. [online]. Available from: https://www.acces sdata.fda.gov/drugsatfda_docs/label/2018/210607lbl.pdf.
MUDr. Jan Dvořák
Centrum Očkování a cestovní medicíny Avenier
Veleslavínská 150/ 44
162 00 Praha 6

