Dvoudávkové očkovací schéma bivalentní vakcíny proti HPV
M. Holásek
Medicínské oddělení společnosti GlaxoSmithKline, s. r. o.
Souhrn
Odhaduje se, že přibližně 5,2 % všech karcinomů je asociováno s infekcí onkogenními papilomaviry. Nejtěsněji je tento vztah popsán u karcinomu děložního hrdla. V prevenci tohoto nádoru má významné místo vakcinace. Nejefektivnější účinnost vakcín je zajištěna při očkování před začátkem pohlavního života. Studie na mladistvých prokázaly u HPV vakcín noninferiorní hladiny protilátek po očkování pouze dvěma dávkami ve srovnání s titry protilátek u starších dívek a žen po aplikaci tří dávek ve standardním schématu. Nově se HPV vakcíny mohou aplikovat u mladistvých ve dvoudávkovém schématu.
Klíčová slova
lidský papillomavirus – karcinom děložního hrdla – dvoudávkové schéma HPV vakcinace – HPV vakcína
Úvod
Od 1. 4. 2012 je v ČR ze zdravotního pojištění hrazeno očkování proti infekci nejčastějšími vysoce rizikovými genotypy lidských papilomavirů (human papillomavirus – HPV). Finanční krytí je určeno pro dívky mezi 13 a 14 lety. Tato vakcinace by měla významně snížit výskyt rakoviny děložního hrdla, která je celosvětově druhým nejčastějším nádorovým onemocněním žen. V ČR je každý rok diagnostikováno více než 1 000 nových případů rakoviny děložního hrdla a zhruba 400 žen na toto onemocnění zemře. Vakcíny proti HPV infekci jsou v ČR dostupné již od r. 2006, resp. 2007.
Vztah HPV infekce k nádorovým onemocněním
Infekce vysoce rizikovými genotypy lidských papilomavirů je spojena s etiopatogenezí některých nádorů. Mezi tyto nádory patří především karcinomy hrdla děložního, vulvy, vaginy a penisu, ale zjistilo se významné zastoupení HPV infekce i u nádorů hrtanu, intenzivní výzkum probíhá i u karcinomů jiných lokalit. Nejsilnější, prakticky 100% asociace HPV infekce je prokázána u zhoubných nádorů děložního hrdla. Spojení nejdůležitějších malignit s HPV infekcí zobrazuje tab. 1. Uvádí se, že alespoň jednou za život se HPV infekcí nakazí přibližně 75−80 % žen v naší populaci, čímž se tato infekce stává jednou z nejčastějších sexuálně přenosných chorob. Vysoce rizikových HPV genotypů je 13−18. Nejdůležitější v etiopatogenezi lidských karcinomů jsou HPV 16, 18, 31, 33 a 45.
Prevence karcinomu děložního hrdla
Primární prevence, která je nejúčinnější, spočívá v zabránění kontaktu s HPV. Pokud opomeneme absolutní sexuální abstinenci, která je v reálném životě nepříliš obvyklá, je jedinou možnou formou primární prevence vakcinace proti HPV infekci. Je jasné, že HPV vakcinace bude mít největší efekt u dívek, které se s HPV dosud ve svém životě nesetkaly – jsou tzv. HPV naivní. Sekundární prevence spočívá v aktivním vyhledávání již přednádorových změn (prekanceróz), které se následně mohou řešit chirurgicky, ale jako každý chirurgický zákrok mohou mít negativní dopad na zdravotní stav, především ve zvýšeném riziku předčasného porodu.
Primární prevence karcinomu děložního hrdla
Jednou z možností je očkování bivalentní vakcínou, která je indikována pro prevenci přednádorových genitálních lézí (cervikálních, vulválních a vaginálních) a karcinomu děložního hrdla, které jsou způsobeny určitými vysoce rizikovými HPV genotypy. Je standardně aplikována ve třech dávkách, a to ve schématu 0– 1– 6 měsíců. U HPV naivní skupiny dívek a žen tato vakcína deklaruje 100% účinnost proti nejtěžším přednádorovým změnám CIN 3 (těžké cervikální intraepiteliální neoplazie) způsobeným genotypy HPV 16 a 18. Postupem času se prokázala určitá míra zkřížené ochrany i proti některým nevakcinálním HPV genotypům – HPV 31, 33, 45, 51. Celková účinnost bivalentní vakcíny proti lézím CIN 3+ (CIN 3 nebo invazivní karcinom děložního hrdla) bez ohledu na genotyp HPV, který lézi vyvolal, je u HPV naivních dívek 93 %. Je nutné připomenout, že výsledky, kterých je dosahováno ve studiích za experimentálních podmínek, se v reálném životě mohou lišit.
Na konci r. 2013 proběhla pro mladší věkové kategorie změna v dávkování bivalentní vakcíny. Nově se u 9– 14letých dívek vakcína může aplikovat ve dvou dávkách ve schématu 0– 6 měsíců.
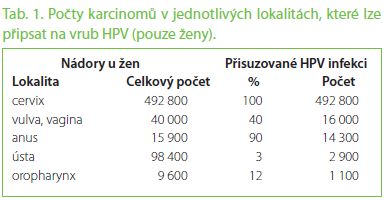
Účinnost u 9–14letých dívek
Studie účinnosti byly prováděny primárně na dívkách a ženách ve věku 15–25 let. Mladší dívky nebyly do těchto studií zahrnuty, protože jejich nedílnou součástí jsou gynekologická vyšetření, která nejsou u takto mladých dívek eticky akceptovatelná. Proto se u nich stanovuje pouze hladina protilátek a porovnává se s hladinami protilátek u 15– 25letých dívek, pro které jsou účinnostní data známa. Pokud je hladina protilátek podobná, pak považujeme účinnost vakcíny u 9– 14letých dívek za minimálně srovnatelnou. Toto přemostění účinnosti se nazývá immuno-bridging a bylo využito také např. u konjugovaných pneumokokových vakcín. Při stanovování hladin protilátek u 9– 14letých dívek po aplikaci bivalentní vakcíny se zjistilo, že tyto dívky tvoří zhruba dvakrát vyšší hladiny protilátek, než starší dívky při stejném režimu aplikace (graf 1). Toto zjištění vedlo k prvním úvahám o možnosti redukce počtu vakcinačních dávek u takto mladých dívek.
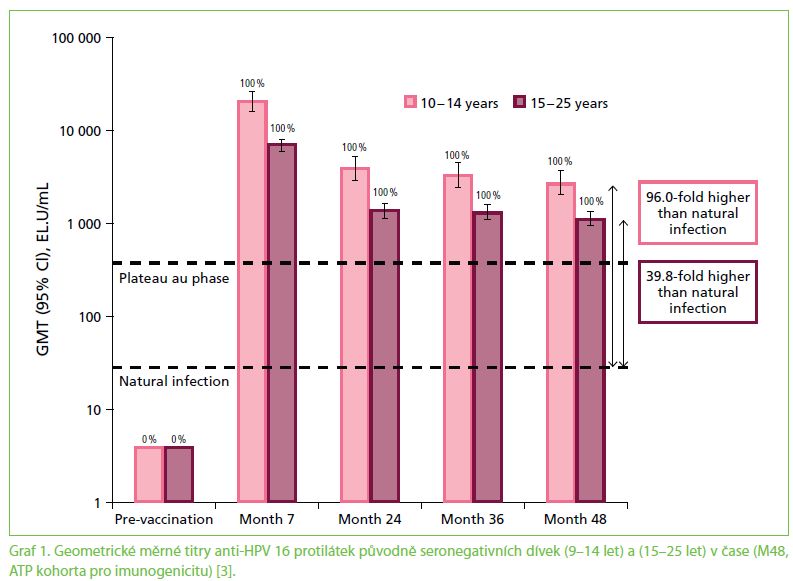
Dvoudávkové schéma bivalentní vakcíny u 9– 14letých dívek bylo ověřeno ve dvou studiích – HPV 048 a HPV 070.
Studie HPV 048 probíhala v Německu a v Kanadě a prokázala, že dvě dávky vakcíny CervarixTM u 9– 14letých dívek indukují po dobu až 48 měsíců srovnatelné celkové hladiny protilátek jako u 15– 25letých dívek po očkování třemi dávkami stejné vakcíny (graf 2). Tato vysoká imunogenita u 9– 14letých dívek byla po aplikaci dvou dávek prokázána pro genotypy HPV 16, 18, 31 a 45.
Studie HPV 070, která probíhala v Německu, Kanadě, Itálii, Thajsku a na Tchai-wanu, porovnávala nejen celkové protilátky proti HPV 16 a 18, ale také specifické neutralizační protilátky a parametry buněčné imunity – T a B lymfocyty. I v těchto parametrech 9– 14leté dívky po aplikaci dvou dávek vakcíny CervarixTM dosahovaly minimálně stejně kvalitních hodnot jako 15– 25leté dívky po třech dávkách, a to jeden měsíc po dokončeném vakcinačním schématu.
Přesvědčivé výsledky těchto studií vedly k tomu, že se 18. 12. 2013 změnilo dávkování vakcíny CervarixTM u 9– 14letých dívek. Nově se tato vakcína aplikuje těmto dívkám ve dvou dávkách ve schématu 0– 6 měsíců.

Pokud je v jakémkoli věku druhá dávka vakcíny podána před pátým měsícem po první dávce, vždy má být podána třetí dávka.
Možné výhody snížení počtu dávek bivalentní vakcíny u 9– 14letých dívek:
- Snížení počtu návštěv pacientek v ordinaci PLDD při HPV vakcinaci.
- Možné zvýšení počtu pacientek, které dokončí celé vakcinační schéma.
- Snížení nákladů ordinace při nakupování HPV vakcín.
- Snížení obav pacientky z vakcinace.
- Úspory pro plátce vakcinace – zdravotní pojišťovny.
Závěr
Karcinom děložního hrdla je důsledkem perzistující infekce onkogenními genotypy HPV. Lze jej označit za sexuálně přenosné a z velké části preventabilní onemocnění. Přítomnost neutralizačních protilátek, které jsou indukovány vakcinací, brání přenosu infekce nejčastějšími onkogenními genotypy. Očkování proti HPV je vysoce účinný způsob zabránění vzniku tohoto nádorového onemocnění. Nejčastější nežádoucí účinky po aplikaci bivalentní vakcíny jsou reakce v místě vpichu, únava, bolest hlavy. Zvláště u dospívajících se před očkováním či po očkování může objevit synkopa, tato synkopa má podklad v psychogenní reakci očkované dívky.
Literatura
1. SPC Cervarix, 22. 8. 2014.
2. Sehnal B et al. Očkování proti HPV infekci – pohled gynekologa. Vakcinologie 2012; 6: 71– 72.
3. Petäjä T, Pedersen C, Poder A et al. Long-term persistence of systemic and mucosal immune response to HPV 16/ 18 AS04 – adjuvanted vaccine in preteen/ adolescent girls and young women. Int J Cancer 2011; 129(9): 2147– 2157.
4. Parkin DM, Bray F. Chapter 2: the burden of HPV-related cancers. Vaccine 2006; 24 (Suppl 3): S3/ 11– S3/ 25.
5. Romanowsky B et al. Immune response to the HPV- 16/ 18 AS04 – adjuvanted vaccine administered as a 2-dose or 3-dose schedule up to 4 years after vaccination. Abstract HPV 048. Eurogin 2013 International Multidisciplinary Congress. Italy: Florence 2013.
6. Puthanakit T et al. Immune responses to a 2-dose schedule of the HPV- 16/ 18 AS04- adjuvanted vaccine in girls (9– 14) versus 3-dose in women (15– 25): a randomised trial. Abstract HPV 070. Eurogin 2013 International Multidisciplinary Congress. Italy: Florence 2013.CZ/ CER/ 0025/ 14a
MUDr. Michal Holásek
Medicínské oddělení společnosti GlaxoSmithKline, s. r. o.
Hvězdova 1734/2c, 140 00 Praha 4
ZKRÁCENÁ INFORMACE O PŘÍPRAVKU: NÁZEV PŘÍPRAVKU – CERVARIXTM INJEKČNÍ SUSPENZE. Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná). SLOŽENÍ: 1 dávka (0,5 ml) obsahuje: Papillomaviri humani typus 16 proteinum L1 20 mikrogramů; Papillomaviri humani typus 18 proteinum L1 20 mikrogramů; lidský papilomavirus = HPV, adjuvovaný na AS04 obsahující: 3- O- deacyl- 4’- monofosforyl-lipid A (MPL) 50 mikrogramů, adsorbovaný na hydroxid hlinitý, hydratovaný (Al(OH)3) celkem 0,5 miligramu Al3+. TERAPEUTICKÉ INDIKACE: k prevenci premaligních genitálních lézí (cervikálních, vulválních a vaginálních) a cervikálního karcinomu, které jsou způsobeny určitými onkogenními typy lidských papilomavirů (HPV). Důležité informace podporující tuto indikaci viz body 4.4 a 5.1 Souhrnu údajů o přípravku. CervarixTM určen k podání dívkám ve věku od 9 let. Dávkování a způsob podání: Dívky 9– 14 let: Doporučené očkovací schéma − 2 dávky v 0 a 6 měsících. Je-li třeba očkovací schéma upravit, druhá dávka může být podána mezi 5 a 7 měsíci po první dávce. Dívky a ženy od 15 let a starší: Doporučené očkovací schéma − 0, 1, 6 měsících. Je-li třeba očkovací schéma upravit, druhou dávku lze podat mezi 1 a 2,5 měsíci po první a třetí dávka mezi 5 a 12 měsíci po první dávce. Pokud v jakémkoli věku je druhá dávka vakcíny podána před 5. měsícem po první dávce, vždy má být podána třetí dávka.* Čas a potřeba podání posilovací dávky (dávek) nebyla stanovena. CervarixTM je určen k intramuskulární aplikaci do oblasti deltového svalu. Kontraindikace: Hypersenzitivita na léčivé látky nebo na kteroukoliv pomocnou látku. Odložit aplikaci u osob trpících akutním vážným horečnatým onemocněním. Přítomnost lehké infekce jako je nachlazení není kontraindikací. Zvláštní upozornění a opatření pro použití: Stejně jako u všech injekčních vakcín musí být i po aplikaci této vakcíny pro případ vzácně se vyskytující anafylaktické reakce okamžitě k dispozici odpovídající lékařská péče a dohled. Zvláště u dospívajících se může jako psychogenní reakce na injekční stříkačku s jehlou objevit po i před očkováním synkopa (mdloba). Ta je během zotavení spojena s různými neurologickými příznaky − např. přechodné poruchy zraku, parestézie a tonicko-klonické křeče končetin. Je důležité v případě mdlob učinit opatření k zamezení zranění. Vakcína nesmí být v žádném případě aplikována intravaskulárně nebo intradermálně. Údaje o subkutánním podání nejsou k dispozici. Stejně jako jiné vakcíny aplikované intramuskulárně, musí být i CervarixTM podáván opatrně osobám s trombocytopenií nebo s jakoukoli poruchou koagulace, u kterých může dojít ke krvácení. Stejně jako u jiných vakcín nemusí být u všech očkovaných jedinců dosaženo ochranné imunitní odpovědi. CervarixTM bude chránit proti nemoci způsobené HPV typy 16 a 18 a v určitém rozsahu proti nemocem způsobeným určitými dalšími příbuznými onkogenními HPV typy. Proto je nutné i nadále pokračovat ve vhodných opatřeních proti sexuálně přenosným nemocem. CervarixTM je určen pouze k profylaktickému podání a nemá žádný efekt na již aktivní HPV infekci nebo klinicky přítomné onemocnění. Neprokázalo se, že by vakcína měla terapeutický efekt. Očkování nenahrazuje pravidelný cervikální skrínink. Vzhledem k tomu, že žádná vakcína není 100% účinná a vakcína CervarixTM neposkytuje ochranu proti všem typům HPV ani proti již existujícím infekcím HPV, zůstává pravidelný cervikální screening kriticky důležitý a má se provádět v souladu s místními doporučeními. Délka ochrany nebyla přesně stanovena. S vyjímkou osob s asymptomatickou infekcí virem lidské imunodeficience (HIV), u kterých jsou dostupná omezená data o imunogenicitě, nejsou žádné údaje o použití vakcíny u osob se sníženou imunitní odpovědí, jako jsou pacienti podstupující imunosupresivní terapii. Stejně jako u jiných vakcín nemusí být u těchto jedinců dosaženo odpovídající imunitní odpovědi. Nejsou žádné údaje o bezpečnosti, imunogenicitě nebo účinnosti, na jejichž základě by bylo možné podpořit vzájemnou zaměnitelnost CervarixuTM s jinými vakcínami proti HPV. Interakce s jinými léčivými přípravky a jiné formy interakce: Jedinci, kteří dostali imunoglobulin nebo krevní deriváty během 3 měsíců před podáním první dávky, byli ze všech klinických studií vyřazeni. Použití s jinými vakcínami: lze současně podat s kombinovanou booster vakcínou obsahující difterii (d), tetanus (T) a pertusi [acelulární] (pa) s nebo bez inaktivované poliomyelitidy (IPV), (dTpa, dTpa- IPV vakcíny), bez klinicky relevantní interference s protilátkovou odpovědí na některou ze složek kterékoli z vakcín; s kombinovanou vakcínou proti hepatitidě A (inaktivovaná) a hepatitidě B (rDNA) (HAB vakcína). Je-li CervarixTM podán současně s jinou injekční vakcínou, musí být vakcíny aplikovány do různých míst. Není důkaz, že by použití hormonální antikoncepce mělo vliv na účinnost CervarixuTM. Podobně jako u jiných vakcín lze očekávat, že u pacientů podstupujících imunosupresivní léčbu, nemusí být po očkování dosaženo odpovídající imunitní odpovědi. Fertilita, těhotenství a kojení: Údaje nejsou dostatečné k tomu, aby bylo možné doporučit podání v průběhu těhotenství. Je třeba očkování odložit až na dobu po ukončení těhotenství. Očkování vakcínou během kojení by se mělo provádět jen tehdy, pokud možné výhody očkování převáží možná rizika.
Nežádoucí účinky: Velmi časté: reakce v místě vpichu včetně bolesti, zarudnutí, otoku; únava, bolest hlavy, myalgie. Časté: horečka (≥ 38 °C), gastrointestinální symptomy včetně nauzey, zvracení, průjmu a bolesti břicha, svědění/ pruritus, vyrážka, kopřivka, arthralgie. Méně časté: závrať, infekce horních cest dýchacích, jiné reakce v místě vpichu. Inkompatibility: Protože chybí studie kompatibility, nesmí být přípravek mísen s jinými léčivými přípravky. Doba použitelnosti: 4 roky. Po vyjmutí z chladničky podat co nejdříve. Nicméně získané údaje značí, že vakcína v jednodávkových baleních zůstává stabilní a může být podána i v případě, že byla uchována mimo chladničku po dobu až 3 dnů při teplotě 8 °C až 25 °C nebo až jeden den při teplotě 25 °C až 37 °C. Zvláštní opatření pro uchovávání: Uchovávejte v chladničce (2– 8 °C). Chraňte před mrazem. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Při uchovávání se ve stříkačce s vakcínou může vytvořit jemný bílý sediment a čirý bezbarvý supernatant. To však není známkou znehodnocení vakcíny. Před aplikací musí být obsah stříkačky před i po protřepání vizuálně zkontrolován, zda neobsahuje jakékoli cizí částice a/ nebo jestli nemá změněný vzhled. Je-li patrná jakákoliv změna vzhledu, je třeba vakcínu vyřadit. Vakcína musí být před aplikací řádně protřepána. Druh obalu a velikost balení: 0,5 ml suspenze v jednodávkové lahvičce se zátkou ve velikosti balení 1, 10 a 100. DRŽITEL ROZHODNUTÍ O REGISTRACI: GlaxoSmithKline Biologicals s.a., Rue de l’Institut 89, B- 1330 Rixensart, Belgie. REGISTRAČNÍ ČÍSLO(A): EU/ 1/ 07/ 419/ 001, EU/ 1/ 07/ 419/ 002, EU/ 1/ 07/ 419/ 003. DATUM PRVNÍ REGISTRACE: 20. 9. 2007. DATUM REVIZE TEXTU: 22. 8. 2014. Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury (EMA) http://www.ema.europa.eu/ .
Tento registrovaný léčivý přípravek je vázán na lékařský předpis. S výjimkou úhrady pro 13leté dívky dle novely zákona č. 48/ 1997 Sb. není hrazen z prostředků veřejného zdravotního pojištění.
Seznamte se PŘEDEM s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku i na www.gskkompendium.cz, na stránkách Státního ústavu pro kontrolu léčiv (SÚKL) pod odkazem Databáze léčiv, nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/ 2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz. Případné nežádoucí účinky prosím hlaste také na cz.safety@gsk.com.
*Prosím všimněte si změny v SPC.

